题目内容
【题目】水和溶液与人们的生产生活密切相关。
(1)我国研制出比漂白粉更高效的饮用水消毒剂“ClO2”,完成制取ClO2反应的化学方程式:Cl2+ 2NaClO2= 2ClO2+________。
(2)衣服上沾有的油污可用汽油洗去,是因为汽油能____(填“溶解”或“乳化”)油污。
(3)在0℃时,氮气的溶解度为0.024的含义是___________________________________。
(4)M物质的溶解度随温度的升高而增大。将80gM物质加入50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示。
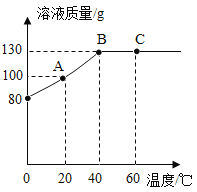
①A点时溶液中剩余固体的质量为________g。
②A、B、C三点所对应的溶液,属于饱和溶液的是____(填字母)。
③在40℃时,M物质的溶解度为_______g。
④若保持溶剂的质量不变,从C点对应的溶液获得M的晶体,可以采用的方法是_________。
(5)实验室用68g质量分数为5%的过氧化氢溶液制取氧气,若过氧化氢完全分解,最多可产生氧气的质量是多少?(写出计算过程)___
【答案】2NaCl 溶解 氮气的压强为101kPa和0℃时,1体积水里最多能溶解0.024体积的氮气 30 AB 160 降温结晶(或降温到40℃以下) 1.6g(详见解析)
【解析】
(1)根据化学反应前后各种原子个数相等,化学方程式为:Cl2+2NaClO2=2ClO2+2NaCl;
(2)汽油能溶解油污;
(3)在0℃时,氮气的溶解度为0.024的含义是指在压强为101kPa和0℃时,1体积水里最多能溶解0.024体积的氮气。
(4)①A点时溶液中溶质的质量为100g-50g=50g,则A点时溶液中剩余固体的质量为:80g-50g=30g;
②A点时溶液中溶质的质量为100g-50g=50g,则A点时溶液中剩余固体的质量为:80g-50g=30g,故A点所对应的溶液为饱和溶液;B点时溶液中溶质的质量为130g-50g=80g,此时溶液恰好饱和;由于M物质的溶解度随温度的升高而增大,C点时对应的温度是60℃时,该温度时的溶解度大于40℃时的溶解度,而C点所对应的溶液中也溶有80g溶质,则C点所对应的溶液属于不饱和溶液,故属于饱和溶液的是AB;
③在40℃时,50g水中最多溶解了80gM,故M物质的溶解度为160g;
④由于M物质的溶解度随温度的升高而增大,若保持溶剂的质量不变,从C点对应的溶液获得M的晶体,可以采用的方法是降温结晶;
(5)设生成氧气的质量为x。
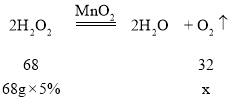
![]() =
=![]()
解得x=1.6g。
答:最多可产生氧气的质量是1.6g。

【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2 和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料N2和H2。
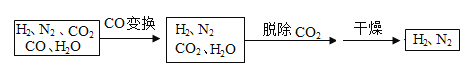
(1)在使用铜催化剂和加热条件下,半水煤气主要成分间发生反应实现了 CO 变换,其化学方程式为:________。
(2)吸收法是脱除CO2的方法之一。已知:
溶质 | Na2CO3 | K2CO3 |
20℃1L饱和溶液中溶质的物质的量mol | 2.0 | 8.0 |
溶质价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3溶液作吸收液,其优点是_;缺点是_。如果选择K2CO3溶液作吸收液,用某种方法可以降低成本,写出这种方法涉及的化学方程式:_。
(3)将一定体积半水煤气依次通过装置Ⅰ~Ⅴ(最后通入氮气确保反应、吸收完全),可以 测定其中H2以及 CO 的物质的量。
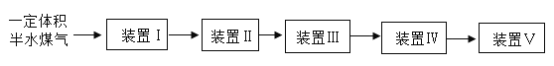
可供选用的装置如下所示(省略夹持仪器):
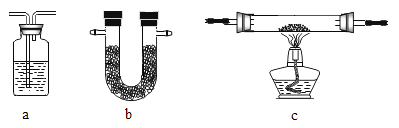
为装置Ⅰ~Ⅴ选择合适的装置与试剂:
装置 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
a | a | _ | _ | b | |
试剂 | _ | 浓硫酸 | CuO | _ | _ |
装置Ⅰ、Ⅱ的作用是____________。要确定半水煤气中H2物质的量,应测量的数据是______。