题目内容
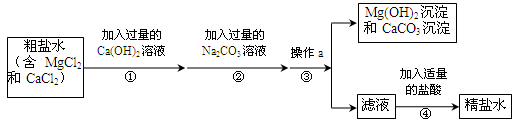
(7分)有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种。为探究其成分,小燕老师取用一定量样品,加足量水溶解,过滤得到白色沉淀甲和无色滤液乙。
写出上述操作中可能发生反应的化学方程式: 。
过滤时用到玻璃棒,玻璃棒的作用是 。
【探究活动一】 奋进小组探究白色沉淀甲的成分。
【探究活动二】 智慧小组探究白色固体样品中可能含有 ,设计了如下实验。
【反思】 实验Ⅱ中步骤①加入过量试剂的目的是 。
【结论】 通过两个小组的共同探究,得出了原白色固体样品含有的成分。
写出上述操作中可能发生反应的化学方程式: 。
过滤时用到玻璃棒,玻璃棒的作用是 。
【探究活动一】 奋进小组探究白色沉淀甲的成分。
| 实验操作 | 实验现象 | 结 论 |
| 取白色沉淀甲,滴加足量的稀硝酸 | 沉淀部分消失 | 白色沉淀甲中一定含有 |
| 实验操作 | 实验现象 | 结论 | |
| 实验Ⅰ | 取适量无色滤液乙,加入碳酸钠溶液 | 无明显现象 | 无色滤液乙中一定不含 |
| 实验Ⅱ | 步骤①:取适量无色滤液乙,加入过量的 溶液,过滤 | 生成白色沉淀 | 原白色固体样品中一定存在该物质 |
| 步骤②:取步骤①中的滤液,滴加 溶液 | | ||
【结论】 通过两个小组的共同探究,得出了原白色固体样品含有的成分。
BaCl2+Na2CO3=BaCO3↓+2NaCl 引流
【探究活动一】BaCO3和BaSO4
【探究活动二】NaOH
实验Ⅰ:BaCl2
实验Ⅱ:步骤①:BaCl2[或Ba(NO3)2或CaCl2或Ca(NO3)2 ]
步骤②:无色酚酞 酚酞溶液变红(或FeCl3,产生红褐色沉淀 …)
【反思】除去滤液中的Na2CO3,排除干扰
【探究活动一】BaCO3和BaSO4
【探究活动二】NaOH
实验Ⅰ:BaCl2
实验Ⅱ:步骤①:BaCl2[或Ba(NO3)2或CaCl2或Ca(NO3)2 ]
步骤②:无色酚酞 酚酞溶液变红(或FeCl3,产生红褐色沉淀 …)
【反思】除去滤液中的Na2CO3,排除干扰
试题分析:有一包白色固体样品,可能是碳酸钠、硫酸钡、氢氧化钠、氯化钡中的一种或几种,取用一定量样品,加足量水溶解,过滤得到白色沉淀和无色滤液,沉淀可能使硫酸钡,也可能是碳酸钡,如果是碳酸钡,发生的反应为BaCl2+Na2CO3=BaCO3↓+2NaCl,过滤时用到玻璃棒,玻璃棒的作用是引流,白色沉淀中加稀盐酸,沉淀部分溶解,所以沉淀中既有硫酸钡,也有碳酸钡,可能有氢氧化钠,取适量无色滤液乙,加入碳酸钠溶液,无明显现象,无色滤液乙中一定不含氯化钡,第二个实验室检验氢氧化钠,必须先出去碳酸钠,所以可以加氯化钙,与碳酸钠反应生成碳酸钙和氯化钠,过滤,向滤液中加酚酞,酚酞变红,则溶液中存在氢氧化钠,加过量的氯化钙的目的是出去碳酸钠,防止对氢氧化钠的检验造成影响。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目