题目内容
1.A、B、C、D、E、F、G、H、I都是初中化学学过的物质,其中E、F、H均为黑色固体B为紫红色固体,D为混合物,它们之间有如图的转化关系(部分生成物已省去)试推断: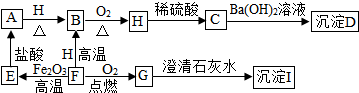
(1)用化学式表示物质AH2、物质DBaSO4,Cu(OH)2;
(2)指出G的一种用途灭火;
(3)H→C的反应基本类型H2SO4+CuO═CuSO4+H2O;
(4)写出F→E的化学方程式3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑.
分析 根据题干提供的信息,找准此题的解题突破口,B为紫红色固体,则B是铜,铜与氧气加热反应生成的黑色固体H是氧化铜,氧化铜与稀硫酸反应生成的C是硫酸铜,硫酸铜与氢氧化钡反应得到的沉淀D是混合物,则D中含有硫酸钡和氢氧化铜;F是黑色固体,能在氧气中燃烧生成的G使澄清的石灰水变浑浊,则G是二氧化碳,I是碳酸钙,F是碳,碳高温下与氧化铁反应生成的E能与盐酸反应,则E是铁,与盐酸反应生成的A能与氧化铜反应生成铜,则A是氢气.
解答 解:B为紫红色固体,则B是铜,铜与氧气加热反应生成的黑色固体H是氧化铜,氧化铜与稀硫酸反应生成的C是硫酸铜,硫酸铜与氢氧化钡反应得到的沉淀D是混合物,则D中含有硫酸钡和氢氧化铜;F是黑色固体,能在氧气中燃烧生成的G使澄清的石灰水变浑浊,则G是二氧化碳,I是碳酸钙,F是碳,碳高温下与氧化铁反应生成的E能与盐酸反应,则E是铁,与盐酸反应生成的A能与氧化铜反应生成铜,则A是氢气,代入框图,推断合理;因此:
(1)根据分析,A是氢气,化学式为:H2;D中含有硫酸钡和氢氧化铜,化学式为:BaSO4,Cu(OH)2;
(2)根据分析,G是二氧化碳,可以灭火;
(3)H→C的反应是氧化铜和硫酸的反应,反应的方程式为:H2SO4+CuO═CuSO4+H2O;
(4)F→E的反应是碳和氧化铁的反应,反应的方程式为:3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑;
故答案为:
(1)H2、BaSO4,Cu(OH)2;(2)灭火;
(3)H2SO4+CuO═CuSO4+H2O;(4)3C+2Fe2O3$\frac{\underline{\;高温\;}}{\;}$4Fe+3CO2↑.
点评 本题为框图式物质推断题,完成此题,可以依据题干提供的信息,找准解题的突破口,然后利用物质间的反应通过顺推或逆推得出其他物质的化学式.

| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,碳燃烧一定产生CO2 | |
| B. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,属于置换反应 | |
| C. | 2HCl+Fe═FeCl2+H2↑,铁桶不能装盐酸 | |
| D. | NaOH+HCl═NaCl+H2O,氢氧化钠可以治疗胃酸过多 |
| A. | 26g | B. | 16g | C. | 18g | D. | 30g |
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
| A. | 氯化钠 | B. | 蔗糖 | C. | 小苏打 | D. | 汽油 |
【提出问题】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O;
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应;
②CO2在饱和碳酸氢钠溶液汇总几乎不溶解.
【实验探究】为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入 过量CaCl2溶液; | 白色沉淀产生 | 该反应的化学方程式:Na2CO3+CaCl2═2NaCl+CaCO3↓ |
| (2)将上述反应后的混合液过滤,取滤液加入酚酞试液; | 溶液变红色 | 证明猜想Ⅱ正确 |
【实验探究2】为得到纯净的氢氧化钠固体,小亮明设计了如图1所示的实验流程.请回答下列问题:
(1)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
(2)最终所得氢氧化钠固体质量大于(填“大于”、“等于”或“小于”)变质后样品中氢氧化钠的质量.
【实验反思】
(1)通过本题,你学会了定性检验氢氧化钠的变质和除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考的问题有①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地 ④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差.
(2)向50g Na2co3溶液总逐滴加入一定溶质质量分数的CaCl2溶液,实验过程中,生成沉淀的质量与加入CaCl2溶液的质量关系如图所示,试计算:恰好完全反应时,所得溶液中溶质的质量分数.
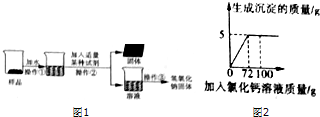
| A. | 用过滤的方法将硬水进行软化 | |
| B. | 用燃烧木炭的方法制备纯净的二氧化碳 | |
| C. | 加适量稀盐酸清洗铁制品表面的铁锈 | |
| D. | 用闻气味的方法区别氧气和二氧化碳 |
| A. | FeCl3、H2SO4 | B. | MgSO4、Ca(OH)2 | C. | NaOH、NaCl | D. | Ca(OH)2、Na2CO3 |
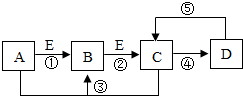 A、B、C、D、E是初中化学中常见的五种物质.在通常情况下,A为黑色粉末状固体,B、C均为无色无味的气体,D为不溶于水的白色固体,在实验室常用含D的物质与稀盐酸反应制取C,单质E是组成空气的主要成分之一.它们之间的关系如图所示(图中反应条件及反应④和⑤中某些反应物、生成物已略去).
A、B、C、D、E是初中化学中常见的五种物质.在通常情况下,A为黑色粉末状固体,B、C均为无色无味的气体,D为不溶于水的白色固体,在实验室常用含D的物质与稀盐酸反应制取C,单质E是组成空气的主要成分之一.它们之间的关系如图所示(图中反应条件及反应④和⑤中某些反应物、生成物已略去).