题目内容
【题目】以下都是课本中实验的改进装置。( 已知:白磷的着火点为40°C)
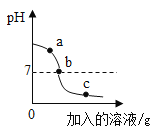
(1)图1实验中,通过对比分析,可探究燃烧的条件需要什么?_____
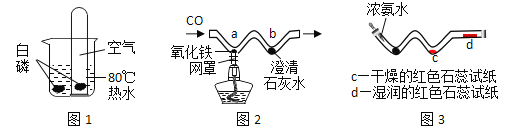
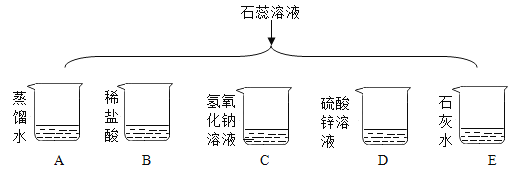
(2)图2实验中,a处反应的化学方程式为_____。
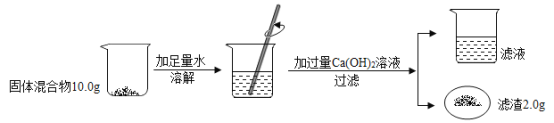
(3)用图3探究分子不断运动时,观察到的明显的现象是什么?_____
【答案】燃烧需要氧气(或O2) 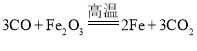 d处湿润的红色石蕊试纸变蓝
d处湿润的红色石蕊试纸变蓝
【解析】
(1)图1实验中,两份白磷分别在热水中,一份接触空气,一份不能接触空气,通过对比分析,可探究燃烧的条件是需要空气(或氧气);
(2)图2实验中,一氧化碳高温还原氧化铁产生铁和二氧化碳的化学方程式为:Fe2O3+3CO![]() 2Fe+3CO2;
2Fe+3CO2;
(3)用图3中,浓氨水挥发出的氨气,不能是干燥的石蕊试纸变色,但能使湿润的红色湿润试纸变蓝;可以观察到: d处湿润的红色石蕊试纸变蓝。

【题目】某兴趣小组对氯酸钾(KClO3)分解反应的催化剂进行研究,在相同的加热条牛下,用下图装置完成表中实验:
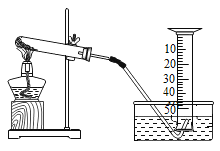
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s。 |
实验1 | 5 | --- | --- | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)编号实验2中5克氯酸钾完全分解后,MnO2的质量为________。
(2)表中所列3种催化剂的催化效果最佳的是___________。
(3)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____________。
(4)氯酸钾在加热的条件下发生分解反应,生成氯化钾与氧气,请写出编号实验2的KClO3分解的化学方程式:____________。
(5)由实验1和实验4可知,KCl_______(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:___________。