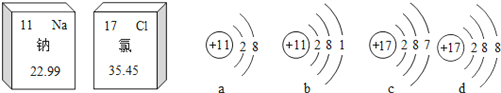题目内容
【题目】自来水厂常用氯气来杀菌消毒,某班学生对氯气的制取、性质、用途进行如下探究:
【查阅资料】氯气(Cl2)是无色有刺激性气味的有毒气体,它的密度比空气大,可溶于水生成盐酸和次氯酸(HClO)
【探究一】制取氯气
(1)实验室常用二氧化锰固体和浓盐酸加热制取氯气,同时还生成氯化锰(其中锰元素显+2价)和水,请写出该反应的化学方程式:。
(2)下图中仪器①的名称是 , 实验室制取氯气应选择的发生装置和最佳收集装置是(填序号)。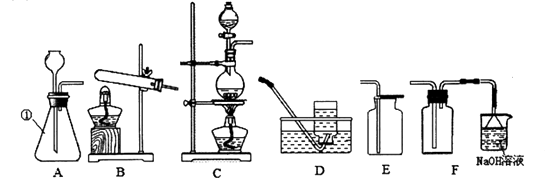
(3)【探究二】氯气的性质
小明用下图一装置探究氯气的漂白性: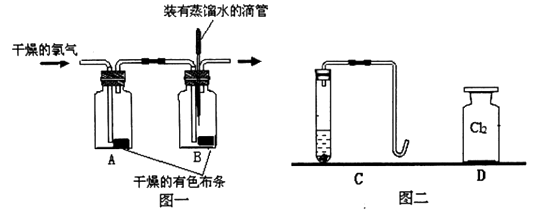
实验步骤:I.将滴管内的蒸馏水滴到B瓶中的干燥有色布条上,布条没有褪色;
II.通入干燥的Cl2 , 发现A瓶中的布条没有褪色,而B瓶中的布条褪色。
①通过上述实验,小明能得到的结论是。
②小颖根据查阅的资料信息,补充做了一个实验:(写出实验步骤和现象),从而得出“次氯酸具有漂白性”的结论。
③小明同学认为,上图一实验装置中有一个明显的缺陷,该装置的不足之处是。
小星用上图二装置探究氯气的助燃性:
实验步骤:I.用锌粒和稀硫酸在C装置中制取氢气,请写出该反应的化学方程式:;
II.先 , 然后再点燃氢气,产生淡蓝色火焰;
III.将燃着的氢气导管缓缓伸到装满氯气的集气瓶D中,观察到氢气继续燃烧并产生
苍白色火焰。请写出该反应的化学方程式:。
【实验反思】:①小星发现氢气在氯气中燃烧时,集气瓶D瓶口上方有大量白雾,你认为产生白雾的可能原因是。
②通过氢气能在氯气中燃烧的实验,你对燃烧有什么新的认识?。
(4)【探究三】氯气的用途
氯气不仅用于消毒,还是重要的化工原料,利用氯气可以制取盐酸、“84”消毒液、漂白粉等。
①已知“84”消毒液的生产原理是:C12+2NaOH=NaCl+NaClO(次氯酸钠)+H20,若向lOOkg16%的氢氧化钠溶液中通入适当的氯气恰好完全反应,理论上可得到“84”消毒液的质量是。
②请仿照“84”消毒液的生产原理,写出用氯气和石灰乳制取漂白粉的化学方程式:。
【答案】
(1)MnO2+4HCl(浓) ![]() MnCl 2+Cl2↑+2H2O
MnCl 2+Cl2↑+2H2O
(2)锥形瓶,CF
(3)干燥的氯气没有漂白性,湿润的氯气具有漂白性,将少量盐酸滴到有色布条上,布条不褪色,缺少尾气处理装置,Zn + H2SO4 = ZnSO4 + H2↑,检验氢气的纯度,H2 + Cl2 ![]() 2HCl,燃烧生成的氯化氢气体与空气中的水蒸气接触,形成的盐酸小液滴,燃烧不一定需要氧气参加(或其他合理答案)
2HCl,燃烧生成的氯化氢气体与空气中的水蒸气接触,形成的盐酸小液滴,燃烧不一定需要氧气参加(或其他合理答案)
(4)114.2Kg,2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】【探究一】(1) 二氧化锰固体和浓盐酸加热生成氯气、氯化锰和水,化学方程式为:MnO2+4HCl(浓) ![]() MnCl 2+Cl2↑+2H2O;(2)仪器①是锥形瓶,实验室制取氯气是固+液加热型,应选择C发生装置,由于氯气有毒,密度比空气大,可溶于水生成盐酸和次氯酸(HClO),最佳收集装置是F;
MnCl 2+Cl2↑+2H2O;(2)仪器①是锥形瓶,实验室制取氯气是固+液加热型,应选择C发生装置,由于氯气有毒,密度比空气大,可溶于水生成盐酸和次氯酸(HClO),最佳收集装置是F;
【探究二】① 通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有褪色,因此甲同学得出结论:干燥的氯气没有漂白性,潮湿的氯气有漂白性;
②由于氯气溶于水生成盐酸和次氯酸(HClO),得出“次氯酸具有漂白性”的结论,要排除盐酸的可能,将少量盐酸滴到有色布条上,布条不褪色;
③由于氯气有毒,应作尾气处理;锌粒和稀硫酸反应生成硫酸锌和氢气,化学方程式为:Zn + H2SO4 = ZnSO4 + H2↑;氢气不纯会爆炸,点燃前应检验氢气的纯度;氢气在氯气中燃烧生成氯化氢气体,化学方程式:H2 + Cl2 ![]() 2HCl;
2HCl;
【实验反思】①燃烧生成的氯化氢气体与空气中的水蒸气接触,形成的盐酸小液滴,看上去就是白雾;
②通过氢气能在氯气中燃烧的实验,可得燃烧不一定需要氧气参加;
【探究三】①设恰好反应吸收的氯气为x
Cl2+ | 2NaOH=NaCl+NaClO+H2O |
71 | 80 |
x | 100kg×16% |
![]()
x=14.2kg
由质量守恒定律可知,理论上可得到“84”消毒液的质量是100kg+14.2kg=114.2kg;
②氯气和氢氧化钙反应生成氯化钙、次氯酸钙和水,化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
【考点精析】根据题目的已知条件,利用氧气的化学性质和质量守恒定律及其应用的相关知识可以得到问题的答案,需要掌握氧气的化学性质:特有的性质:支持燃烧,供给呼吸;①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案【题目】下列有关量的变化图象与其对应叙述相符的是
A | B | C | D |
|
|
|
|
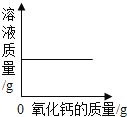
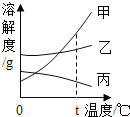
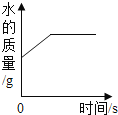
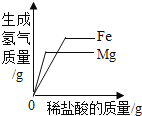
常温下,向一定量的饱和石灰水中加入氧化钙 | t℃时,向等质量的甲、乙、丙三种物质中分别加水配成饱和溶液,所得溶液质量最小的是丙 | 向一定质量的过氧化氢的水溶液中加入二氧化锰 | 向等质量的铁和镁中分别加入足量的稀盐酸 |
A. A B. B C. C D. D