题目内容
【题目】物质发生化学变化的前后,总质量是否发生改变?是增加、减小还是不变?小刘、小李按下面的步骤进行探究:
(1)提出假设:物质发生化学变化前后总质量不变。
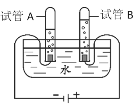
(2)设计并进行实验:小刘设计的实验装置和选用药品如A所示,小李设计的实验装置和选用药品如B所示,他们在反应前后都进行了规范的操作、准确的称量和细致的观察。
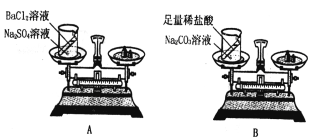
①小李的实验所发生的化学反应方程式为:_________________________
②实验结论:
小刘认为:在化学反应中,生成物的总质量与反应物的总质量相等;
小李认为:在化学反应中,生成物总质量与反应物总质量不相等。
③你认为________的结论正确,导致另一个实验结论错误的原因是:_______________________
④请从原子的角度分析你认为正确的结论的原因:____________________________________
⑤使用上述实验装置,请你选择另外两种药品进行实验达到实验目的,这两种药品可以是________和_______(填化学式)[注:以上四种药品均不能再用]
【答案】Na2CO3+2HCl=2NaCl+H2O+CO2↑ 小刘 反应生成的二氧化碳逸出 反应前后原子的种类,数目,质量都不改变 Fe CuSO4(合理即可)
【解析】
①小李的实验所发生的化学反应是碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为: Na2CO3+2HCl=2NaCl+H2O+CO2↑;
③小刘的结论是正确的,因为在质量守恒定律中,反应物的总质量等于生成物的总质量,小李的实验中反应生成的二氧化碳逸出,导致生成物总质量与反应物总质量不相等,可将反应物放在密闭容器中进行实验;
④从原子的角度解释质量守恒定律,是因为反应前后原子的种类,数目,质量都不改变;
⑤使用上述实验装置,选择药品验证质量守恒定律时,两种物质要能发生化学反应,不生成气体物质,故可选用Fe与CuSO4(合理即可)。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某同学为了测定实验室中氯酸钾样品中氯酸钾的质量分数。取15克该样品与5克二氧化锰混合。加热该混合物T1时间后(假设杂质不参加反应),冷却,称量剩余固体的质量,重复以上操作,依次称得加热T2、T3、T4时间后剩余固体的质量,记录如下表。
加热时间 | T1 | T2 | T3 | T4 |
剩余固体质量(克) | 18.2 | 16.6 | 15.2 | 15.2 |
(1)完全反应后产生氧气的质量是____________ 。
(2)计算氯酸钾样品中氯酸钾的质量分数(要求书写计算过程,结果保留0.1%)___________。