题目内容
【题目】某化工厂排出的废液中含有AgNO3、Cu(NO3)2和Zn(NO3)2.为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如下方案进行实验:
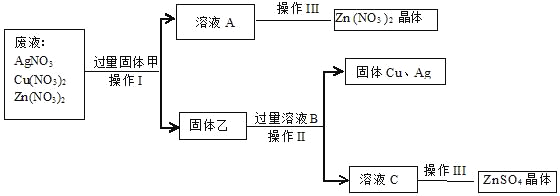
根据实验推断:
(1)固体甲是_____(填化学式);加入甲过量的目的是_____。
(2)操作I的名称是_____;操作III的名称是_____;这两个操作都用到的仪器名称是_____。
(3)滤液A中的溶质是_____(填化学式);固体乙的成分是_____(填化学式)。
(4)溶液B跟固体乙反应的化学方程式是_____。
【答案】Zn 使硝酸银、硝酸铜完全反应 过滤 蒸发 玻璃棒、铁架台 Zn(NO3)2 Ag、Cu、Zn Zn+H2SO4═ZnSO4+H2↑
【解析】
(1)固体甲是Zn;加入甲过量的目的是使硝酸银、硝酸铜完全反应;
(2)操作I的名称是过滤,操作III的名称是蒸发,这两个操作都用到的仪器名称是玻璃棒、铁架台;
(3)滤液A中的溶质是Zn(NO3)2,这是因为锌和硝酸银、硝酸铜反应生成硝酸锌;
固体乙的成分是Ag、Cu、Zn,这是因为锌过量,和硝酸银反应生成银,和硝酸铜反应生成铜;
(4)溶液B是稀硫酸,跟固体乙中的锌反应生成硫酸锌和氢气,反应的化学方程式是:Zn+H2SO4═ZnSO4+H2↑。

练习册系列答案
相关题目