题目内容
【题目】已知元素周期表中第三周期各元素原子结构示意图如下,分析错误的是
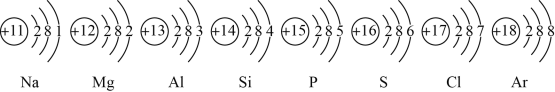
A. 以上原子的核外都有三个电子层
B. Na+和Mg2+的核外电子数不相同
C. Na与Cl形成化合物的化学式为NaCl
D. 在化学反应中氯原子容易得到电子
【答案】B
【解析】
A.如图可以得知以上原子核外都有三个电子层,故A正确;
B.Na失去1个电子,Mg有2个离子形成离子。Na+、Mg+的核外电子数均为10,相同。故B错误;
C.Na最外层电子数为1.易失去形成Na+;显+1价,CH最外层有7个中子,易得到1个电子形成Cl-,显-1价,故可形成的化合物为NaCl。故C正确;
D.Cl最外层电子数为7,在化学反应中易得1个电子形成Cl-。故D正确。
故选B。

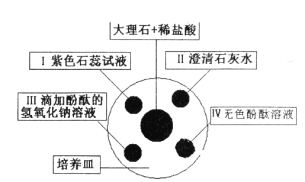
【题目】金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于___________________材料。
(2)航空煤油是飞机的燃料,它主要是由___________炼制的。
(3)铁易生锈,提出防止铁生锈的一种方法__________。
(4)特种钢中含有少量![]() 。
。![]() 和
和![]() 粉混合在高温下反应可得到
粉混合在高温下反应可得到![]() ,该反应的化学方程式为_______.
,该反应的化学方程式为_______.
(5)![]() 受热分解生成高熔点的
受热分解生成高熔点的![]() 。
。![]() 可用作阻燃剂,其主要原理是__________(选填序号)。
可用作阻燃剂,其主要原理是__________(选填序号)。
a 分解吸热,降低可燃物着火点 b ![]() 覆盖燃烧物,隔绝氧气
覆盖燃烧物,隔绝氧气
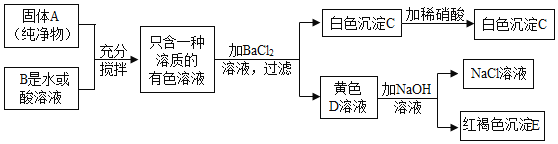
(二)制备还原性铁粉
实验室利用废铁屑(含少量![]() )为原料制备还原性铁粉的流程如下:
)为原料制备还原性铁粉的流程如下:
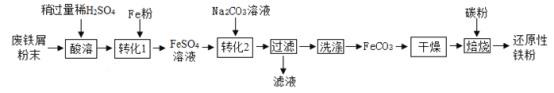
(1)![]() 粉可使“酸溶”产生的
粉可使“酸溶”产生的![]() 转化为
转化为![]() ,该反应的化学方程式为_________.
,该反应的化学方程式为_________.
(2)检验![]() 已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加_______溶液,无明显现象。
已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加_______溶液,无明显现象。
(3)“干燥”时有少量![]() 发生下列转化:
发生下列转化:![]() ,该转化的化学方程式为____________________.
,该转化的化学方程式为____________________.
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是_______________.
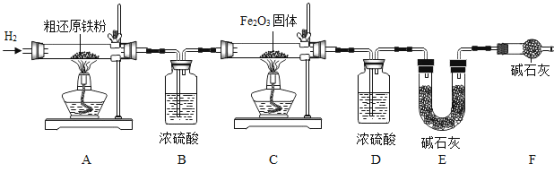
(三)测定还原性铁粉的组成
还原性铁粉中含有少量![]() ,小组同学在老师的指导下进行以下实验。
,小组同学在老师的指导下进行以下实验。
资料:①![]() 在加热时与
在加热时与![]() 反应能生成相应氧化物。
反应能生成相应氧化物。
②![]() 不与酸反应。
不与酸反应。
实验1:取![]() 样品,加入足量稀
样品,加入足量稀![]() ,充分反应后生成
,充分反应后生成![]() 。
。
实验2:另取![]() 样品,按下图进行实验。
样品,按下图进行实验。
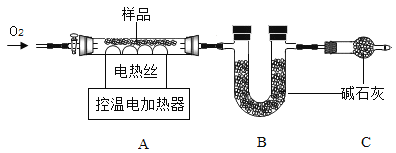
表:装置A和B的质量变化
装置 | A | B |
反应前 | 300.00 | 400.00 |
反应后 | m | 400.44 |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要_____________________________
(2)装置C的作用是____________________________________
(3)![]() 中,
中,![]() ___________。表中m的值是____________.
___________。表中m的值是____________.
反思:若用空气替代![]() 进行实验,测得
进行实验,测得![]() 的值偏小,可能的原因是___________。
的值偏小,可能的原因是___________。