题目内容
某学习小组围绕“气体实验室制取”进行了研讨.请你参与完成下面的问题.
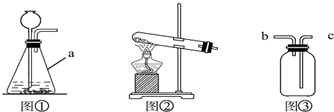
(1)原理分析:实验室制取CO2的化学方程式为 .不用Na2CO3与盐酸反应制取CO2的原因是 .实验室用图②制取氧气的化学方程式为 .
(2)发生装置:图①装置中仪器a的名称是 .实验室常用无水醋酸钠固体与碱石灰在加热的情况下制CH4,应选图 (填序号)作为发生装置.
(3)收集装置:实验室收集NH3应采用的方法是 .收集有毒气体SO2时,常采用图③收集装置,气体应从 (填字母)端通入.
(4)实验操作:用KMnO4制取O2的操作过程可概括为“组装仪器→ →装入药品→固定试管→加热→收集气体→停止加热”.
(5)实验反思:在加热KClO3制O2的过程中,发现产生O2的速率很慢,经检查不是KClO3变质,也不是装置气密性不好,你认为最可能的原因是 .

(1)原理分析:实验室制取CO2的化学方程式为
(2)发生装置:图①装置中仪器a的名称是
(3)收集装置:实验室收集NH3应采用的方法是
(4)实验操作:用KMnO4制取O2的操作过程可概括为“组装仪器→
(5)实验反思:在加热KClO3制O2的过程中,发现产生O2的速率很慢,经检查不是KClO3变质,也不是装置气密性不好,你认为最可能的原因是
考点:常用气体的发生装置和收集装置与选取方法,实验室制取氧气的反应原理,制取氧气的操作步骤和注意点,二氧化碳的实验室制法,书写化学方程式、文字表达式、电离方程式
专题:常见气体的实验室制法、检验、干燥与净化
分析:(1)从大理石(主要成分是CaCO3)和稀盐酸(主要成分HCl),二者接触即可发生反应生成氯化钙、水和二氧化碳.碳酸钠和稀盐酸反应速率过快,产生的二氧化碳气体来不及收集;由图②可以看出是加热固体制氧气,由于试管口没有棉花团,所以只能用氯酸钾和二氧化锰的混合物制氧气去分析解答;
(2)从仪器的图形和用途;无水醋酸钠固体与碱石灰在加热的情况下制CH4,由于反应需要加热去分析解答;
(3)从氨气的密度比空气小且易溶于水,由二氧化硫的相对分子质量=32+16×2=64>29(空气的平均相对分子质量),可知二氧化硫的密度比空气大去分析解答;
(4)众KMnO4制取O2,由于制取气体,所以组装完仪器后,就要检查装置的气密性,防止因漏气而收集不到氧气去分析解答;
(5)从加热KClO3制O2,如果加入二氧化锰,二氧化锰能加快氯酸钾的反应速率,而本身的质量和化学性质不变去分析解答;
(2)从仪器的图形和用途;无水醋酸钠固体与碱石灰在加热的情况下制CH4,由于反应需要加热去分析解答;
(3)从氨气的密度比空气小且易溶于水,由二氧化硫的相对分子质量=32+16×2=64>29(空气的平均相对分子质量),可知二氧化硫的密度比空气大去分析解答;
(4)众KMnO4制取O2,由于制取气体,所以组装完仪器后,就要检查装置的气密性,防止因漏气而收集不到氧气去分析解答;
(5)从加热KClO3制O2,如果加入二氧化锰,二氧化锰能加快氯酸钾的反应速率,而本身的质量和化学性质不变去分析解答;
解答:解:(1)大理石(主要成分是CaCO3)和稀盐酸(主要成分HCl),二者接触即可发生反应生成氯化钙、水和二氧化碳.化学化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;由于碳酸钠和稀盐酸反应速率过快,产生的二氧化碳气体来不及收集;由图②可以看出是加热固体制氧气,由于试管口没有棉花团,所以只能用氯酸钾和二氧化锰的混合物制氧气,加热氯酸钾和二氧化锰的混合物,生成氯化钾和氧气,其化学方程式为:2KClO3
2KCl+3O2↑;
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑ 反应速率过快不易收集 2KClO3
2KCl+3O2↑;
(2)由仪器的图形和用途可知为:锥形瓶;无水醋酸钠固体与碱石灰在加热的情况下制CH4,由于反应需要加热,所以发生装置应选图②;故答案为:锥形瓶 ②;
(3)由于氨气的密度比空气小且易溶于水,故只能用向下排空气法;由二氧化硫的相对分子质量=32+16×2=64>29(空气的平均相对分子质量),可知二氧化硫的密度比空气大,所以气体应从c端进入,否则集气瓶中的空气不易排出;故答案为:向下排空气法 c;
(4)用KMnO4制取O2,由于制取气体,所以组装完仪器后,就要检查装置的气密性,防止因漏气而收集不到氧气;故答案为:检查装置的气密性;
(5)加热KClO3制O2,如果加入二氧化锰,二氧化锰能加快氯酸钾的反应速率,而本身的质量和化学性质不变;如果KClO3没有变质,装置气密性好,发现产生O2的速率很慢,说明没有催化剂;故答案为:没加二氧化锰做催化剂.
| ||
| △ |
故答案为:CaCO3+2HCl═CaCl2+H2O+CO2↑ 反应速率过快不易收集 2KClO3
| ||
| △ |
(2)由仪器的图形和用途可知为:锥形瓶;无水醋酸钠固体与碱石灰在加热的情况下制CH4,由于反应需要加热,所以发生装置应选图②;故答案为:锥形瓶 ②;
(3)由于氨气的密度比空气小且易溶于水,故只能用向下排空气法;由二氧化硫的相对分子质量=32+16×2=64>29(空气的平均相对分子质量),可知二氧化硫的密度比空气大,所以气体应从c端进入,否则集气瓶中的空气不易排出;故答案为:向下排空气法 c;
(4)用KMnO4制取O2,由于制取气体,所以组装完仪器后,就要检查装置的气密性,防止因漏气而收集不到氧气;故答案为:检查装置的气密性;
(5)加热KClO3制O2,如果加入二氧化锰,二氧化锰能加快氯酸钾的反应速率,而本身的质量和化学性质不变;如果KClO3没有变质,装置气密性好,发现产生O2的速率很慢,说明没有催化剂;故答案为:没加二氧化锰做催化剂.
点评:发生装置的选择取决于反应物的状态和反应条件,收集装置的选择则取决于制取气体的水溶性和密度.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
下列化学现象描述不正确的是( )
| A、铜在空气中灼烧,表面逐渐从红色(或紫红色)变成黑色 |
| B、铁丝在氧气中燃烧,火星四射,生成四氧化三铁 |
| C、木炭在氧气中燃烧更旺,发出白光,放出热量 |
| D、硫在氧气中燃烧,火焰呈明亮蓝紫色,生成一种刺激性气味的气体 |


