题目内容
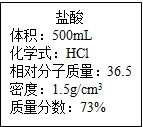 实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签内容如图所示,请你根据标签上提供的数据解答下列问题:(1)用40mL该浓盐酸可以配制溶质质量分数为18.25%的盐酸
(2)取13.8gR2C03(R为未知金属元素)固体完全溶于水得到100g溶液,加入一定质量溶质质量分数为34.2%的Ba(OH)2溶液,恰好完全反应,过滤,得到沉淀的质量为19.7g.再向所得的滤液中滴入酚酞指示剂,溶液变红,逐滴加入一定质量刚配好的盐酸,溶液刚好变成无色.
①R2C03发生反应的化学方程式为
②利用已知条件求解所加Ba(OH)2溶液质量(x)的比例式为
③R的元索符号是
④加入盐酸的质量为
⑤若向反应后所得溶液中加入127.7g水,则此时溶液中溶质的质量分数是
分析:(1)利用浓溶液配制稀溶液时,通过加水稀释则可完成配制;在加水稀释前后,溶液中溶质的质量不变,根据这一特点,可利用浓盐酸中溶质质量计算出稀盐酸的质量;
(2)可溶性碳酸R2C03的溶液盐与氢氧化钡溶液发生复分解反应,生成碳酸钡沉淀和碱ROH溶液;根据恰好完全反应时生成沉淀碳酸钡的质量,由反应的化学方程式可计算参加反应的氢氧化钡溶液的质量及金属R的相对原子质量,从而判断金属R为哪种元素;还可根据反应生成的沉淀计算出生成碱ROH的质量,再根据碱ROH与滴入的稀盐酸恰好完全反应,计算所加入盐酸的质量及反应生成KCl的质量;最后根据加入127.7g水溶质KCl质量不变,利用溶液的溶质质量分数=
×100%,求出加水后所得溶液的溶质质量分数.
(2)可溶性碳酸R2C03的溶液盐与氢氧化钡溶液发生复分解反应,生成碳酸钡沉淀和碱ROH溶液;根据恰好完全反应时生成沉淀碳酸钡的质量,由反应的化学方程式可计算参加反应的氢氧化钡溶液的质量及金属R的相对原子质量,从而判断金属R为哪种元素;还可根据反应生成的沉淀计算出生成碱ROH的质量,再根据碱ROH与滴入的稀盐酸恰好完全反应,计算所加入盐酸的质量及反应生成KCl的质量;最后根据加入127.7g水溶质KCl质量不变,利用溶液的溶质质量分数=
| 溶质质量 |
| 溶液质量 |
解答:解:(1)由标签可知:浓盐酸的密度为1.5g/cm3,溶质的质量分数为73%
溶质质量分数为18.25%的盐酸的质量=
≈240g
故答案为:240;
(2)①碳酸R2C03的溶液盐与氢氧化钡溶液发生复分解反应,通过相互交换成分,生成碳酸钡沉淀和碱ROH;
故答案为:R2C03+Ba(OH)2=BaC03↓+2ROH;
②所加Ba(OH)2溶液质量x
R2C03+Ba(OH)2=BaC03↓+2ROH
171 197
34.2%x 19.7g
=
x=50g
故答案为:
=
;
③设R元素的相对原子质量为r
R2C03+Ba(OH)2=BaC03↓+2ROH
2r+60 197
13.8g 19.7g
=
r=39
根据元素的相对原子质量可查得R为钾元素,元素符号为K
故答案为:K;
④设生成19.7g碳酸钡沉淀的同时生成KOH质量为y
K2C03+Ba(OH)2=BaC03↓+2KOH
197 112
19.7g y
=
y=11.2g
设完全中和11.2gKOH需要HCl质量为a,反应生成KCl质量为b
KOH+HCl=KCl+H2O
56 36.5 74.5
11.2 a b
=
a=7.3g
=
b=14.9g
加入质量分数为18.25%的盐酸质量=
=40g
故答案为:40g;
⑤向反应后所得溶液中加入127.7g水,则此时溶液中溶质的质量分数=
×100%=5%
故答案为:5%.
溶质质量分数为18.25%的盐酸的质量=
| 40mL×1.5g/cm3×73% |
| 18.25% |
故答案为:240;
(2)①碳酸R2C03的溶液盐与氢氧化钡溶液发生复分解反应,通过相互交换成分,生成碳酸钡沉淀和碱ROH;
故答案为:R2C03+Ba(OH)2=BaC03↓+2ROH;
②所加Ba(OH)2溶液质量x
R2C03+Ba(OH)2=BaC03↓+2ROH
171 197
34.2%x 19.7g
| 171 |
| 197 |
| 34.2%x |
| 19.7g |
故答案为:
| 171 |
| 197 |
| 34.2%x |
| 19.7g |
③设R元素的相对原子质量为r
R2C03+Ba(OH)2=BaC03↓+2ROH
2r+60 197
13.8g 19.7g
| 2r+60 |
| 13.8g |
| 197 |
| 19.7g |
根据元素的相对原子质量可查得R为钾元素,元素符号为K
故答案为:K;
④设生成19.7g碳酸钡沉淀的同时生成KOH质量为y
K2C03+Ba(OH)2=BaC03↓+2KOH
197 112
19.7g y
| 197 |
| 19.7g |
| 112 |
| y |
设完全中和11.2gKOH需要HCl质量为a,反应生成KCl质量为b
KOH+HCl=KCl+H2O
56 36.5 74.5
11.2 a b
| 56 |
| 11.2g |
| 36.5 |
| a |
| 56 |
| 11.2g |
| 74.5 |
| b |
加入质量分数为18.25%的盐酸质量=
| 7.3g |
| 18.25% |
故答案为:40g;
⑤向反应后所得溶液中加入127.7g水,则此时溶液中溶质的质量分数=
| 14.9g |
| 100g+50g-19.7g+40g+127.7g |
故答案为:5%.
点评:根据质量守恒定律,向反应后所得溶液中加入127.7g水此时溶液中溶质的质量=碳酸钾溶液质量+氢氧化钡溶液质量-碳酸钡沉淀的质量+稀盐酸溶液的质量+加入水的质量.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
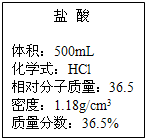 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题. 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.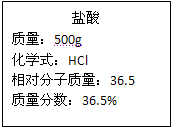 实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题: 实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.
实验室有一瓶浓盐酸,瓶上标签如图所示,请你根据标签上提供的数据解答下列问题.