题目内容
【题目】根据如图中a、b、c三种物质的溶解度曲线,回答下列问题:
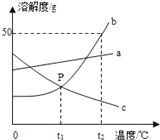
(1)P点表示在t1℃时,两物质的溶解度关系为b___c(填“>”、“<”或“=”);
(2)将t2℃时,a、b、c三种物质的饱和溶液降温到t1℃,所得溶液溶质质量分数的大小关系为____;
(3)t2℃时,40g b加入到50g水中充分溶解后,所得溶液的溶质质量分数为____;
(4)将t2℃时150gb的饱和溶液稀释成20%的溶液,需要加水____g。
【答案】= a>b>c 33.3% 100
【解析】
(1)溶解度曲线的交点表示物质的溶解度相同,故填:=;
(2)t1℃时,a物质的溶解度最大,b、c物质的溶解度相等,降低温度,a、b物质的溶解度减小,c物质的溶解度增大,应该按照t2℃时的溶解度计算,所以将t2℃时,a、b、c三种物质的饱和溶液降温至t1,所得溶液溶质质量分数大小关系为a>b>c;故填:a>b>c;
(3)t2℃时,将40gb物质加入到50g水中充分溶解后,所得溶液的质量=25g+50g=75g,溶液的质量分数=![]() ≈33.3%;
≈33.3%;
(4)t2℃时,b物质的溶解度是50g,所以将150gb的饱和溶液稀释成质量分数为20%的溶液需加水![]() -150g=100g.
-150g=100g.

【题目】实验一:如图是实验室制取气体常用的装置,回答问题:
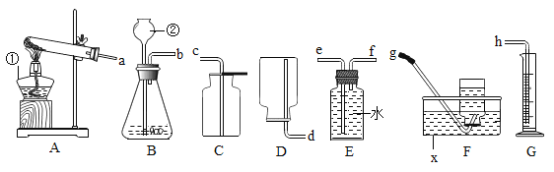
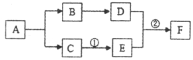
(1)写出标号仪器的名称:①___________________、②_______________________;
(2)若实验室要用同一装置制取并收集O2和CO2,最好选择____________装置组合(填标号),写出用该装置制取O2的化学方程式____________________________________________________________。
(3)实验室用锌与稀硫酸反应来制取氢气并测定氢气的体积,请从图中选择最佳的装置进行组合,整套装置的导管口连接顺序是________(填标号)
Aa→d Bb→g Cb→e→f→h Db→f→e→h
(4)氨气(NH3)是一种无色有刺激性气味的气体,密度比空气小,极易溶于水,实验室常用加热氯化铵和氢氧化钙的固体混合物制取氨气。可选用如图中____________(填标号)装置组合制取并收集氨气。若用如图装置收集,氨气应从________(填“a”或“b”)导管口进入。
实验二:某同学将光亮的镁条放入NaHCO3饱和溶液中,镁条消失并产生大量气泡和白色固体。为确定产生的气体和白色固体的成分,该同学进行了如下的探究。
(查阅资料)①Mg(HCO3)2能溶于水;
②MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物。
③碱石灰主要成分是NaOH和CaO的混合物。
(猜想假设)①白色固体可能是Mg(OH)2;
②白色固体可能是MgCO3;
③白色固体可能是__________________。
(进行实验)
(1)收集并点燃产生的气体,火焰呈淡蓝色,火焰上方罩涂有澄清石灰水的小烧杯,无明显现象,则该气体为_________。
(2)对白色固体进行实验:
实验步骤 | 现象 | 结论 |
①取洗净后的白色固体,加入足量的________ | 观察到______ | 白色固体一定含有MgCO3 |
②取一定量白色固体,充分加热至不再产生气体,将产生的气体先通入碱石灰,再通入浓硫酸,分别称量装置反应前后的质量 | 碱石灰增重,浓硫酸不变 | 白色固体一定含有_______,可能含有___。 |
(反思评价)为进一步确定可能含有的物质,对实验②如何改进,写出具体的操作方法和结论_______________。