题目内容
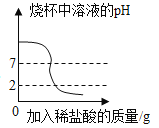
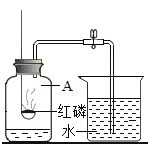
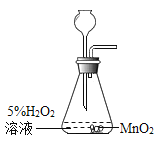
【题目】某实验小组利用如图所示装置测量空气中氧气体积分数并取得成功.
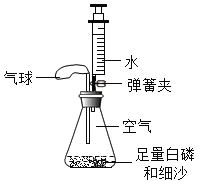
(查阅资料)白磷的着火点为40℃.
(提出问题)氧气体积约占空气总体积的多少?
(实验准备)锥形瓶内空气体积为230mL,注射器中水的体积为50mL,该装置气密性良好.
(实验探究)装入药品,按图所示连接好仪器,夹紧弹簧夹.先将锥形瓶底部放入热水中,白磷很快被引燃,然后将锥形瓶从热水中取出.
(现象分析)
(1)将锥形瓶底部放入热水中,白磷被引燃,说明燃烧不能缺少的一个条件是__________,足量的白磷在锥形瓶中未能全部燃烧,说明瓶内剩余气体__燃烧(填“支持”或“不支持”).写出白磷燃烧的化学方程式:_________.
(2)在整个实验过程中,可观察到气球的变化是___________.
(3)待白磷熄灭、锥形瓶冷却到室温后,打开弹簧夹,还可观察到的现象是:①注射器中的水自动喷射出来,②当注射器中的水还剩约4mL时停止下流.导致这些现象发生的原因是:__.
(得出结论)氧气体积约占空气总体积的![]() .
.
【答案】可燃物的温度要达到着火点 不支持 4P+5O2![]() 2P2O5 先鼓后瘪(其它合理描述也可) ①白磷燃烧消耗了锥形瓶中的氧气,使瓶中气压降低;②锥形瓶中氧气约占46mL,当注射器中的水进入锥形瓶约46mL后,瓶中气压与外界相当
2P2O5 先鼓后瘪(其它合理描述也可) ①白磷燃烧消耗了锥形瓶中的氧气,使瓶中气压降低;②锥形瓶中氧气约占46mL,当注射器中的水进入锥形瓶约46mL后,瓶中气压与外界相当
【解析】
(1)根据燃烧的条件、白磷的性质及燃烧的现象分析回答;
(2)根据瓶内压强的变化分析气球的变化;
(3)根据瓶内压强的变化及空气中氧气的体积分数分析。
(1)将锥形瓶底部放入热水中,白磷很快被引燃,说明燃烧不能缺少的一个条件是温度达到着火点;足量的白磷在锥形瓶中未能全部燃烧,说明瓶内剩余气体不支持燃烧;白磷燃烧生成了五氧化二磷,反应的化学方程式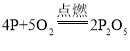 。
。
(2)白磷燃烧时放出大量的热,使瓶内压强增大,由于白磷燃烧消耗了氧气,又冷却到室温,瓶内压强减小。所以,可观察到气球的变化是先变大,后缩小。
(3)由于白磷燃烧消耗了氧气,瓶内压强减小.所以,注射器中的水自动喷出来.又由于空气中氧气的体积分数约占空气的![]() ,所以,当注射器中的水还剩下约50mL-230mL×
,所以,当注射器中的水还剩下约50mL-230mL×![]() =4mL时停止下流。
=4mL时停止下流。

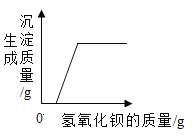
【题目】氯化镁是制取镁的原料之一。现要测定某化工产品(含MgCl2和KCl)中所含的氯化镁质量分数,进行实验:先将10g样品完全溶于水,然后把50g一定质量分数的氢氧化钾溶液平均分五次加入样品溶液中,充分振荡,实验所得数据见下表:
编号 | 1 | 2 | 3 | 4 | 5 |
加入氢氧化钾溶液的质量/g | 10 | 10 | 10 | 10 | 10 |
生成沉淀的质量/g | 0.58 | a | 1.74 | 2.32 | 2.32 |
请分析上述数据,回答下列问题:
(1)表中a为______。
(2)样品中的氯化钾属于化肥中的______肥。
(3)所用的氢氧化钾溶液中溶质的质量分数是___________。
(4)计算样品中氯化镁的质量分数是多少_______________?(写出计算过程)
【题目】除去下列物质中的杂质,所选用的方法不正确的是( )
物质(括号内为杂质) | 操作方法 | |
A | CO2(CO) | 通入氧气点燃 |
B | NaCl溶液(Na2CO3) | 加稀盐酸至恰好不再产生气泡为止 |
C | CaO(CaCO3) | 高温 |
D | 铁粉(锌粉) | 加过量FeSO4溶液充分反应后过滤、洗涤、干燥 |
A. AB. BC. CD. D