题目内容
(1)钛和钛合金被认为是21世纪的重要金属材料.钛可通过如下反应制得:TiCl4+2Mg=Ti+2MgCl2,若要制得24g钛,需要镁的质量多少克?
(2)某小组同学将530g碳酸钠溶液加入到280g石灰乳(水和氢氧化钙的混合物)中,使之恰好完成反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数?
(2)某小组同学将530g碳酸钠溶液加入到280g石灰乳(水和氢氧化钙的混合物)中,使之恰好完成反应,所得溶液中溶质的质量分数为1%,计算加入的碳酸钠溶液中溶质的质量分数?
分析:(1)据反应的化学方程式TiCl4+2Mg
Ti+2MgCl2,由生成钛的质量24g计算消耗金属镁的质量.
(2)根据混合时所发生的反应Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,恰好完全反应后所得溶液为氢氧化钠溶液,此时溶液的溶质质量分数=
×100%,反应后溶液的质量可根据质量守恒定律,由反应前混合物的质量总和减去生成的沉淀碳酸钙而求得,如此一来,只需要用碳酸钠的质量表示出生成的氢氧化钠的质量和形成沉淀的质量,即可利用反应后溶液中的溶质的质量分数建立等而计算出碳酸钠的质量,再使用溶质的质量分数计算公式计算出原碳酸钠溶液的溶质质量分数.
| ||
(2)根据混合时所发生的反应Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,恰好完全反应后所得溶液为氢氧化钠溶液,此时溶液的溶质质量分数=
| 生成氢氧化钠的质量 |
| 反应后溶液的质量 |
解答:解:(1)需要镁的质量为x
TiCl4+2Mg
Ti+2MgCl2,
48 48
x 24g
=
x=24g
(2)设碳酸钠的质量为x,反应生成沉淀碳酸钙的质量为m,生成氢氧化钠的质量为n.
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100 80
x m n
=
=
m=
n=
所以所得溶液的溶质质量分数=
×100%=1%
解得x=10.6g
加入的碳酸钠溶液中溶质的质量分数=
×100%=2%
答:加入的碳酸钠溶液中溶质的质量分数是2%.
答:(1)制得24g钛,需要镁的质量为24g;(2)加入的碳酸钠溶液中溶质的质量分数是2%.
TiCl4+2Mg
| ||
48 48
x 24g
| 48 |
| 48 |
| x |
| 24g |
x=24g
(2)设碳酸钠的质量为x,反应生成沉淀碳酸钙的质量为m,生成氢氧化钠的质量为n.
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100 80
x m n
| 106 |
| x |
| 100 |
| m |
| 80 |
| n |
m=
| 100x |
| 106 |
n=
| 80x |
| 106 |
所以所得溶液的溶质质量分数=
| ||
530g+280g-
|
解得x=10.6g
加入的碳酸钠溶液中溶质的质量分数=
| 10.6g |
| 530g |
答:加入的碳酸钠溶液中溶质的质量分数是2%.
答:(1)制得24g钛,需要镁的质量为24g;(2)加入的碳酸钠溶液中溶质的质量分数是2%.
点评:根据化学方程式可以表示反应中各物质的质量比,由反应中任一物质的质量可以计算出反应中其它物质的质量,第二题中利用质量守恒定律计算反应后溶液的质量对于本题的解决至关重要,反应后溶液的质量=碳酸钠溶液的质量+所加石灰乳的质量-生成的碳酸钙沉淀的质量.

练习册系列答案
相关题目
 35、人们的日常生活离不开金属和金属材料,高科技、新材料的开发和应用也需要它.下面是小明同学对该部分知识的学习与探究.
35、人们的日常生活离不开金属和金属材料,高科技、新材料的开发和应用也需要它.下面是小明同学对该部分知识的学习与探究.

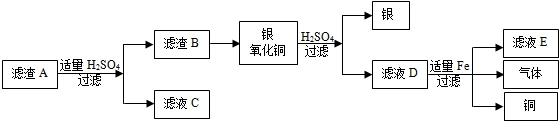
 金属盒金属化合物是重要的资源,生活、工业、农业生产都离不开金属盒金属化合物.
金属盒金属化合物是重要的资源,生活、工业、农业生产都离不开金属盒金属化合物.