题目内容
(2012?平谷区一模)生产、生活中广泛使用着金属及金属材料.
(1)金属钛(Ti)及钛的合金被认为是21世纪重要的金属材料.地壳中的钛主要以氧化物的形式存在,其中钛元素的化合价是+4价,该氧化物的化学式为
(2)防止铁制品锈蚀需要了解铁锈蚀的条件.铁锈蚀的条件是:
(3)实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硫酸和铁粉分别回收银和铜,设计如下方案.
先在废液中加入过量的铁粉,充分反应后过滤得到滤渣A,其成分为
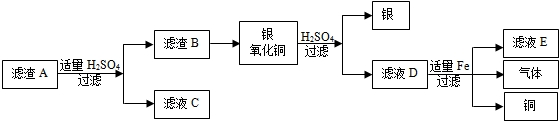
①先再废液中加入过量的铁粉,过量的目的是
②含有硫酸亚铁的滤液有
③如果在过滤操作中发现滤液浑浊,在仪器洁净、滤纸未破损的前提下,你认为滤液的浑浊的原因可能是
(1)金属钛(Ti)及钛的合金被认为是21世纪重要的金属材料.地壳中的钛主要以氧化物的形式存在,其中钛元素的化合价是+4价,该氧化物的化学式为
TiO2
TiO2
.(2)防止铁制品锈蚀需要了解铁锈蚀的条件.铁锈蚀的条件是:
与氧气、水同时接触
与氧气、水同时接触
.(3)实验室废液中含有硝酸银、硝酸铜,实验小组利用稀硫酸和铁粉分别回收银和铜,设计如下方案.
先在废液中加入过量的铁粉,充分反应后过滤得到滤渣A,其成分为
Fe、Cu、Ag
Fe、Cu、Ag
.再对滤渣A按如下流程图处理:
①先再废液中加入过量的铁粉,过量的目的是
使AgNO3、Cu(NO3)2充分反应
使AgNO3、Cu(NO3)2充分反应
.②含有硫酸亚铁的滤液有
C、E
C、E
(填框图中字母).③如果在过滤操作中发现滤液浑浊,在仪器洁净、滤纸未破损的前提下,你认为滤液的浑浊的原因可能是
过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯
过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯
.分析:(1)根据化学式的书写方法填空,正价元素在左边,负价元素在右边,正负化合价代数和为零;
(2)根据铁锈蚀的条件回答.
(3)金属和盐溶液反应时,在金属活动性顺序表中只有前面的金属可以排在它后面的金属从盐溶液中置换出来,钾、钙、钠除外.废液中加入过量的铁,置换出银和铜,银和氧化铜中加入稀硫酸,银不能与稀硫酸反应,氧化铜和硫酸反应,过滤得到银;滤液D中含有硫酸铜和稀硫酸,加入适量铁,置换出铜.
(2)根据铁锈蚀的条件回答.
(3)金属和盐溶液反应时,在金属活动性顺序表中只有前面的金属可以排在它后面的金属从盐溶液中置换出来,钾、钙、钠除外.废液中加入过量的铁,置换出银和铜,银和氧化铜中加入稀硫酸,银不能与稀硫酸反应,氧化铜和硫酸反应,过滤得到银;滤液D中含有硫酸铜和稀硫酸,加入适量铁,置换出铜.
解答:解:(1)氧化物是只有两种元素组成,钛元素的化合价是+4价,氧元素的化合价为-2价,根据化合价原则,该氧化物的化学式为 TiO2.
(2)铁锈蚀的条件是:铁与氧气和水同时接触.
(3)过量铁粉与硝酸银、硝酸铜完全反应置换出银和铜以及剩余了铁,故滤渣中A的成分为:Fe、Cu、Ag;
①在废液中加入过量的铁粉,过量的目的是使AgNO3、Cu(NO3)2充分反应;
②滤渣A中有铁,与硫酸反应成硫酸亚铁,故滤液C中含有硫酸亚铁,滤液D为硫酸铜与铁反应生成硫酸亚铁,故滤液E中含有硫酸亚铁.
③过滤操作中,滤液浑浊,由于仪器洁净、滤纸不破损,原因为过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯.
故答案为:(1)TiO2;(2)与氧气、水同时接触;(3)Fe、Cu、Ag;①使AgNO3、Cu(NO3)2充分反应;②C、E;③过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯;
(2)铁锈蚀的条件是:铁与氧气和水同时接触.
(3)过量铁粉与硝酸银、硝酸铜完全反应置换出银和铜以及剩余了铁,故滤渣中A的成分为:Fe、Cu、Ag;
①在废液中加入过量的铁粉,过量的目的是使AgNO3、Cu(NO3)2充分反应;
②滤渣A中有铁,与硫酸反应成硫酸亚铁,故滤液C中含有硫酸亚铁,滤液D为硫酸铜与铁反应生成硫酸亚铁,故滤液E中含有硫酸亚铁.
③过滤操作中,滤液浑浊,由于仪器洁净、滤纸不破损,原因为过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯.
故答案为:(1)TiO2;(2)与氧气、水同时接触;(3)Fe、Cu、Ag;①使AgNO3、Cu(NO3)2充分反应;②C、E;③过滤时漏斗中液面高于滤纸边缘,导致液体直接进入烧杯;
点评:主要考查了金属活动性顺序的应用,根据反应判断金属的活动性强弱,根据金属的活动性强弱来判断金属和盐溶液是否发生,培养学生应用知识解决问题的能力.

练习册系列答案
 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
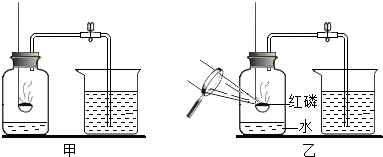 (2012?平谷区一模)图甲所示的实验用来测定空气中氧气的体积分数.实验时要先关闭止水夹,将过量红磷在空气中点燃后迅速插入集气瓶中,盖紧胶塞,待红磷熄灭后,冷却至室温,打开止水夹,观察现象.
(2012?平谷区一模)图甲所示的实验用来测定空气中氧气的体积分数.实验时要先关闭止水夹,将过量红磷在空气中点燃后迅速插入集气瓶中,盖紧胶塞,待红磷熄灭后,冷却至室温,打开止水夹,观察现象.