题目内容
为了测定某铜锌合金中锌的质量分数,某同学利用一定量的该合金与稀硫酸反应,进行了三次实验,相关的实验数据记录如下表.| 实验 物质用量 | 第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 10 | 10 | 10 |
| 所用稀硫酸的质量/g | 50 | 100 | 150 |
| 剩余固体质量/g | 3.5 | 3.0 | 3.0 |
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
【答案】分析:(1)由图表数据可知,第二次和第三次实验合金中的锌完全反应,因为Cu的金属活动性在(H)后,不能与稀硫酸发生反应,故完全反应后剩余固体的质量就是合金中铜的质量;据此计算出合金中锌的质量,然后根据“铜锌合金中锌的质量分数= ×100%”计算即可;
×100%”计算即可;
(2)因为第一次实验硫酸完全反应,有10g-3.5g=6.5g锌参加反应,利用锌与稀硫酸反应的化学方程式和参与反应的锌的质量,列出比例式,就可计算出50g稀硫酸中硫酸的质量,然后根据“溶质质量分数= ×100%”计算即可.
×100%”计算即可.
解答:解:(1)铜锌合金中锌的质量分数= ×100%═70%;
×100%═70%;
(2)第一次实验50g稀硫酸与10g该合金反应时,有6.5g锌参加反应,锌有剩余,而硫酸完全反应.设50g稀硫酸中硫酸的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65,98
6.5g,x
∴ =
= ,
,
解之得:x=9.8g,
稀硫酸中硫酸的质量分数为: ×100%=19.6%.
×100%=19.6%.
答:(1)该铜锌合金中锌的质量分数为70%;(2)稀硫酸中硫酸的质量分数为19.6%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.
 ×100%”计算即可;
×100%”计算即可;(2)因为第一次实验硫酸完全反应,有10g-3.5g=6.5g锌参加反应,利用锌与稀硫酸反应的化学方程式和参与反应的锌的质量,列出比例式,就可计算出50g稀硫酸中硫酸的质量,然后根据“溶质质量分数=
 ×100%”计算即可.
×100%”计算即可.解答:解:(1)铜锌合金中锌的质量分数=
 ×100%═70%;
×100%═70%;(2)第一次实验50g稀硫酸与10g该合金反应时,有6.5g锌参加反应,锌有剩余,而硫酸完全反应.设50g稀硫酸中硫酸的质量为x,
Zn+H2SO4═ZnSO4+H2↑
65,98
6.5g,x
∴
 =
= ,
,解之得:x=9.8g,
稀硫酸中硫酸的质量分数为:
 ×100%=19.6%.
×100%=19.6%.答:(1)该铜锌合金中锌的质量分数为70%;(2)稀硫酸中硫酸的质量分数为19.6%.
点评:本题主要考查学生运用化学方程式和溶质质量分数公式综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
为了测定某铜锌合金中锌的质量分数,某同学利用一定量的该合金与稀硫酸反应,进行了三次实验,相关的实验数据记录如下表.
(1)计算该铜锌合金中锌的质量分数.
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
| 实验 物质用量 |
第一次 | 第二次 | 第三次 |
| 所取合金的质量/g | 10 | 10 | 10 |
| 所用稀硫酸的质量/g | 50 | 100 | 150 |
| 剩余固体质量/g | 3.5 | 3.0 | 3.0 |
(2)计算所用稀硫酸中溶质的质量分数.(结果精确到0.1%)
(可能用到的相对原子质量H-1 O-16 S-32 Cu-64 Zn-65)
为了测定某铜锌合金中铜的质量分数,取合金样品跟稀盐酸反应.三次实验的有关数据如下表:
(1)根据上表中的数据分析,当铜锌合金中的锌与稀盐酸中的HCl恰好完全反应时,合金样品的质量与稀盐酸的质量之比为 .
(2)计算该铜锌合金中铜的质量分数. .
| 实验编号 | 所需合格样品的质量/g | 所取稀盐酸的质量/g | 生成氢气的质量/g |
| 1 | 10.0 | 40.0 | 0.1 |
| 2 | 10.0 | 50.0 | 0.1 |
| 3 | 20.0 | 36.5 | 0.1 |
(2)计算该铜锌合金中铜的质量分数.
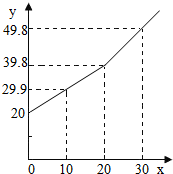 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: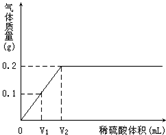 为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题:
为了测定某铜锌合金中锌的质量分数,进行了如下实验:准确称取20.0g合金,向其中不断加入稀硫酸,观察到有气泡逸出,实验过程中测得产生气体的质量与所加稀硫酸的体积关系如图所示.回答下列问题: