题目内容
 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:(1)铜锌合金与稀盐酸的质量比为
(2)反应中共生成氢气
(3)合金中铜的质量分数是多少?(结果保留0.1%)
分析:图中曲线明显变化时的折点表示物质恰好完全反应,折点对应的稀盐酸的质量为20g,由此可以计算出(1)的答案;折点对应的烧杯内剩余物总质量为38.8g,与加入烧杯内物质的总质量40g少0.2g,这是由于生成氢气造成的;由氢气质量根据锌与盐酸反应的化学方程式可以计算出合金中铜的质量分数.
解答:解:(1)图中曲线明显变化时的折点表示物质恰好完全反应;
折点对应的稀盐酸的质量为20g;
合金的质量为20g.
因此合金与稀盐酸的质量比为20g:20g=1:1.
(2)生成氢气的质量为
20g+20g-38.8g=0.2g
(3)设合金中铜的质量分数为x.
Zn+2HCl═ZnCl2+H2↑
65 2
20g?(1-x) 0.2g
=
,x=67.5%
答:(1)1:1.(2)0.2g.
(3)合金中铜的质量分数67.5%.
折点对应的稀盐酸的质量为20g;
合金的质量为20g.
因此合金与稀盐酸的质量比为20g:20g=1:1.
(2)生成氢气的质量为
20g+20g-38.8g=0.2g
(3)设合金中铜的质量分数为x.
Zn+2HCl═ZnCl2+H2↑
65 2
20g?(1-x) 0.2g
| 65 |
| 2 |
| 20g?(1-x) |
| 0.2g |
答:(1)1:1.(2)0.2g.
(3)合金中铜的质量分数67.5%.
点评:本题主要考查含杂质物质的化学方程式计算,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88
为了倡导环保理念,两会期间使用含有碳酸钙的“石头纸”.某研究小组为了测定其中碳酸钙0.88 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: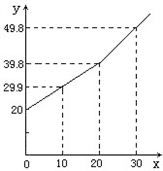
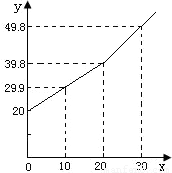 某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问:
某研究小组为了测定某铜锌合金中铜的质量分数,取20g合金放在烧杯中,将一定量的稀盐酸分若干次加入烧杯中,反应过程的质量关系如下图所示(x表示加入稀盐酸的质量/g,y表示烧杯中余下物质的总质量/g).问: