题目内容
【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对双氧水分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g 10%H2O2溶液与1.0g MnO2均匀混合
Ⅱ.将x g 10%H2O2溶液与1.0g CuO均匀混合
在相同温度下,比较两组实验产生O2的快慢.
Ⅰ中反应的化学方程式是 。
Ⅱ中x的值应为 。
(2)乙探究了影响双氧水分解速度的某种因素.实验数据记录如下:
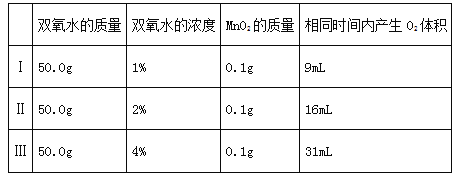
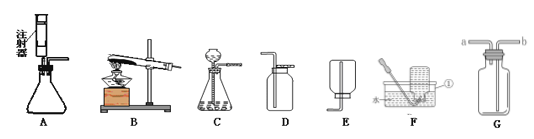
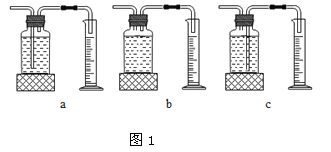
本实验中,测量O2体积的装置是 (填编号)
实验结论:在相同条件下, ,双氧水分解得越快。
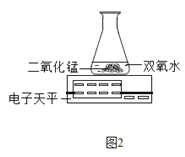
(3)丙用如图2装置进行实验,通过比较 也能达到实验目的。
【答案】①I 2H2O2![]() 2H2O+O2↑ Ⅱ、3.0g
2H2O+O2↑ Ⅱ、3.0g
② c ;双氧水浓度越大;相同时间天平读数差值大小
【解析】
试题分析:(1)过氧化氢分解生成的是水和氧气:2H2O2![]() 2H2O+O2↑;要探究不同的催化剂对过氧化氢分解速率的影响,那么应该采用控制变量法,即只有催化剂的种类不变,其他的条件要完全相同,故x取3.0g;
2H2O+O2↑;要探究不同的催化剂对过氧化氢分解速率的影响,那么应该采用控制变量法,即只有催化剂的种类不变,其他的条件要完全相同,故x取3.0g;
(2)要用装置来测量生成的氧气的体积,就要用排水法,即通过用量筒测量用氧气排出的水的体积,故选c装置;由表格数据可知,过氧化氢的浓度越大,分解速率越快;
(3)由于过氧化氢分解产生的氧气会逸散到空气中,故可比较锥形瓶中剩余物质的质量来比较反应的快慢。

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案
相关题目