题目内容
【题目】同学们在学习碱的化学性质时,进行了如图所示的实验。
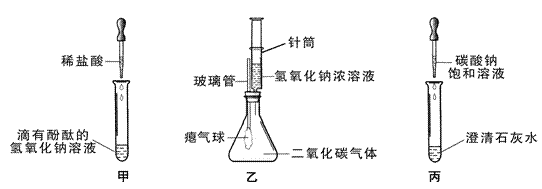
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式_________。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是_________。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】 废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和________(写物质名称)。
②还含有能使废液呈碱性的物质。能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠 小红认为:只有氢氧化钙 小林认为:是氢氧化钠和碳酸钠
你认为还可能是___________(写一种猜想)
【实验设计】请你设计实验证明小林的猜想正确,把下面表格填写完整即可。
实验操作 | 实验现象 | 实验结论 |
取少量废液缸中上层清液于试管中,加入___,静置。 | _____________。 | 小林的猜想正确 |
【答案】 HCl + NaOH== NaCl+ H2O 气球胀大 氯化钠 NaOH 和Ca(OH)2【或NaOH】 过量的氯化钡溶液 有白色沉淀产生,溶液仍为红色
【解析】(1)此反应的反应物是氯化氢和氢氧化钠,生成物是氯化钠和水,化学方程式为为:HCl+NaOH═NaCl+H2O;
(2)乙实验中滴加氢氧化钠溶液,二氧化碳被氢氧化钠溶液吸收,瓶内压强减低,在外界大气压的作用下,气球膨胀起来;
(4)①在所有反应物、生成物和溶液中的水中,唯一不发生化学反应的是氯化钠和水。废液缸中的废液浑浊并呈红色,浑浊说明一定含碳酸钙,呈红色说明一定有酚酞和碱;
②本题所有反应物生成物中溶液显碱性的有氢氧化钠、氢氧化钙和碳酸钠,而其中的碳酸钠和氢氧化钙不能共存,所以碱性物质可以是只有碳酸钠或只有氢氧化钙或只有氢氧化钠或氢氧化钙和氢氧化钠,也可以是氢氧化钠和碳酸钠等;
【实验设计】要验证氢氧化钠和碳酸钠存在,取少量滤液于试管中,加入过量氯化钙或氯化钡溶液,振荡、静置;若有白色沉淀,溶液呈红色,说明有氢氧化钠和碳酸钠,则小林的猜想正确。

【题目】小华和小慧两位同学分别用如图所示的装置进行电解水实验。为了增强水的导电性,实验前小华向水中加入硫酸钠固体.则b试管中产生的气体是__(填化学式)。

小慧在做实验时误将氯化钠当成硫酸钠加入水中,结果在检验b气体时闻到一股刺激性气味.在老师的指导下小华和小慧一起就这一异常现象开展了研究.
【定性研究】
(1)小慧猜想刺激性气味气体是氯化氢或氨气.小华则认为一定不是氨气,理由是______.
在老师指导下得知:①食盐水通电时发生反应:2NaCl+2H2O═2NaOH+H2↑+Cl2↑;
②氯气是一种有刺激性气味的有毒气体.由此可推测该刺激性气味的气体是____。
(2)定剩余溶液中的溶质,小慧进行如下实验,请帮她将实验报告补充完整.
实验操作 | 实验现象 | 实验结论 |
①取少量剩余溶液,滴入氯化铜溶液. | 产生蓝色絮状沉淀 | 溶液中含有_____ |
②将①中反应后混合物过滤,向滤液中加入足量稀硝酸再滴入几滴硝酸银溶液 | _____ | 溶液中含有氯化钠 |
小华则认为实验②不能确定一定有氯化钠,理由是______。
【定量研究】
两位同学按如图所示的实验步骤进行实验:
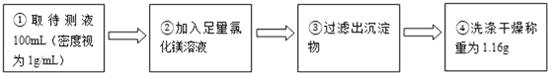
(1)步骤②加入的氯化镁溶液必需足量,其目的是______________。滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,______________(写出实验步骤、现象和结论).
(2)计算待测液中氢氧化钠的质量分数(写出计算过程)_____
【实验反思】若步骤④中缺少洗涤干燥的操作,所测定氢氧化钠的质量分数将__(选填“偏大”、“偏小”或“没影响”).
【题目】化学与生产、生活密切相关。
⑴2017年金鸡贺岁普通纪念币是中国人民银行发行的一枚普通纪念币。该纪念币的产品外环为黄色铜合金,内芯为复合材料(镍带复合白铜)。请回答下列问题:

①下列物质中属于有机合成材料的是______(填字母)。
A.白铜 B.塑料 C.铜丝
②选择铸造纪念币的材料时,无需考虑的因素是______(填字母)。
A.金属的导电性 B.金属的耐腐蚀性
C.金属的硬度 D.金属的价格
⑵中考快要到了,某同学为自己制定了下表所示的食谱:
主食 | 馒头、米饭 |
副食 | 红烧肉、糖醋鱼 |
饮料 | 加钙牛奶 |
①上述食谱中缺乏的营养素主要是______(填字母)。
A.糖类 B.蛋白质 C.维生素
②饮用加钙牛奶,可以有效预防______(填字母)。
A.贫血病 B.佝偻病 C.甲状腺肿大
⑶连徐客专的开工建设,将推动我市走进“高铁时代”。制造高铁需要大量使用铝合金,工业上常通过在高温下电解氧化铝制取金属铝(同时生成一种气体单质),该反应的化学方程式为:______。