题目内容
 某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.
某化学兴趣小组在实验室发现了一瓶标签受到腐蚀(如图)的溶液,他们对此产生了兴趣.
[提出问题]这瓶溶液究竟是什么?
经过询问实验老师平时的药品保管得知,这瓶无色溶液应该是碳酸钠、碳酸氢钠、氯化钠、硫酸钠、硝酸钠中的某一种.为了确定该药品,他们首先进行了理论分析:
(1)小明根据标签上的组成元素认为一定不可能是______.
(2)小英提出,碳酸氢钠、硝酸钠也不可能,你认为她的依据是______.
为了确定该溶液究竟是剩余两种盐的哪一种,他们设计了如下实验.
[设计实验]
| 方法 | 实验操作 | 实验现象 | 实验结论 |
| 一 | 取少量样品于试管中,慢慢滴加BaCl2溶液,静置一段时间,倾去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 | 该瓶无色溶液是______. |
| 二 | 取该瓶溶液,慢慢滴加______溶液 | 产生气泡 | 该瓶无色溶液是Na2CO3.反应的化学方程式是______. |
| 三 | 取少量样品于试管中,慢慢滴加MgSO4溶液 | 产生______ | 该瓶无色溶液是 Na2CO3. |
| 经查阅资料得知上述五种盐里碳酸钠、碳酸氢钠的溶液呈碱性,其余三种盐的溶液呈中性,请你再设计一种实验方法,确定该溶液究竟是哪种盐. | |||
| 四 | ______ | 溶液变红 | 该瓶无色溶液是 Na2CO3. |
(3)方法二的操作有不合理之处,请指出原因:______.
解:(1)氯化钠中不含有氧元素,故不可能是氯化钠;
(2)碳酸氢钠、硝酸钠的化学式中钠元素的右下角没有数字2,故不可能是碳酸氢钠和硝酸钠;
[设计实验]
方法一:根据实验的现象,加入氯化钡产生了沉淀,产生的沉淀能与盐酸反应产生气体,故该物质是碳酸钠,
方法二:碳酸钠能与盐酸反应产生气体,而硫酸钠不与盐酸反应,故可以使用盐酸,与样品混合,观察有无气体产生来确定物质的成分;
方法三:碳酸钠能够和硫酸镁反应产生碳酸镁沉淀.而硫酸钠不反应;
方法四:碳酸钠溶液呈碱性,而硫酸钠的水溶液呈中性,可以使用滴加几滴无色酚酞,观察到溶液变红验证结论;
(3)方法二的操作是“取该瓶溶液”滴加检测试剂,会将该瓶试剂全部污染,无法进行后续实验,应该取少量样品于试管中进行实验.
故答案为:(1)NaCl (2)标签化学式中Na的右下角为2;而这两种物质的化学式中Na元素的右下角不会有2;
[设计实验]
(3)“取该瓶溶液”滴加检测试剂,会将该瓶试剂全部污染,无法进行后续实验.
分析:根据题干提供的信息进行分析,残缺的标签中钠元素的右下角有数字2,且含有氧元素,故不可能是氯化钠、碳酸氢钠和硝酸钠;根据碳酸钠能够和酸、盐等反应产生不同与硫酸钠的现象分析判断.
点评:本题考查了物质的组成特点及物质的性质的检验,完成此题,可以依据标签提供的物质组成特点及碳酸根离子和硫酸根离子检验的方法进行.
(2)碳酸氢钠、硝酸钠的化学式中钠元素的右下角没有数字2,故不可能是碳酸氢钠和硝酸钠;
[设计实验]
方法一:根据实验的现象,加入氯化钡产生了沉淀,产生的沉淀能与盐酸反应产生气体,故该物质是碳酸钠,
方法二:碳酸钠能与盐酸反应产生气体,而硫酸钠不与盐酸反应,故可以使用盐酸,与样品混合,观察有无气体产生来确定物质的成分;
方法三:碳酸钠能够和硫酸镁反应产生碳酸镁沉淀.而硫酸钠不反应;
方法四:碳酸钠溶液呈碱性,而硫酸钠的水溶液呈中性,可以使用滴加几滴无色酚酞,观察到溶液变红验证结论;
(3)方法二的操作是“取该瓶溶液”滴加检测试剂,会将该瓶试剂全部污染,无法进行后续实验,应该取少量样品于试管中进行实验.
故答案为:(1)NaCl (2)标签化学式中Na的右下角为2;而这两种物质的化学式中Na元素的右下角不会有2;
[设计实验]
| 方法 | 实验操作 | 实验现象 | 实验结论 | |
| 一 | Na2CO3 | |||
| 二 | 盐酸 | 2HCl+Na2CO3═2NaCl+CO2↑+H2O | ||
| 三 | 白色沉淀 | |||
| 四 | 取少量样品于试管中,滴加滴加2至3滴酚酞 | |||
分析:根据题干提供的信息进行分析,残缺的标签中钠元素的右下角有数字2,且含有氧元素,故不可能是氯化钠、碳酸氢钠和硝酸钠;根据碳酸钠能够和酸、盐等反应产生不同与硫酸钠的现象分析判断.
点评:本题考查了物质的组成特点及物质的性质的检验,完成此题,可以依据标签提供的物质组成特点及碳酸根离子和硫酸根离子检验的方法进行.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
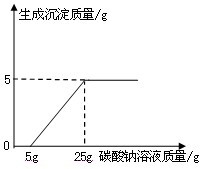 某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
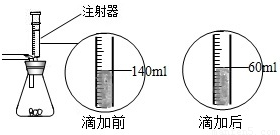
某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.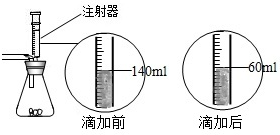 某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)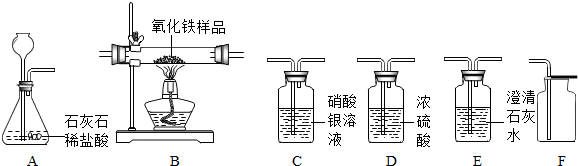
 某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)