题目内容
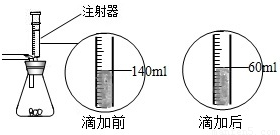
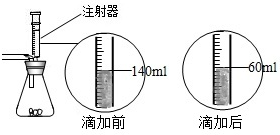 某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)求:(1)在测盐酸质量分数的过程中产生的CO2的质量.
(2)该稀盐酸溶液的溶质质量分数.
(3)反应后所得溶液的溶质质量分数.
分析:(1)利用碳酸钙与盐酸反应的化学方程式,根据碳酸钙的质量可求出二氧化碳的质量.
(2)根据碳酸钙的质量可求出稀盐酸中溶质的质量,稀盐酸的质量可用稀盐酸的体积×密度求出,最后根据
×100%求出稀盐酸溶液中溶质的质量分数.
(3)反应后所得溶液中溶质的质量分数=
×100%,溶质是氯化钙,可根据碳酸钙的质量求出,溶液的质量=所加的所有物质的质量总和-生成的二氧化碳的质量.
(2)根据碳酸钙的质量可求出稀盐酸中溶质的质量,稀盐酸的质量可用稀盐酸的体积×密度求出,最后根据
| 稀盐酸中溶质的质量 |
| 稀盐酸的质量 |
(3)反应后所得溶液中溶质的质量分数=
| 溶质的质量 |
| 反应后所得溶液的质量 |
解答:解:设:生成二氧化碳的质量为x,参加反应的稀盐酸中溶质的质量为y,生成氯化钙的质量为z.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
12.5g×80% y z x
=10g
=
=
=
x=4.4g y=7.3g z=11.1g
所用稀盐酸中溶质的质量分数=
×100%=7.3%
反应后所得溶液中溶质的质量分数=
×100%=10.5%
答:(1)生成二氧化碳的质量为4.4g.
(2)所用稀盐酸中溶质的质量分数为7.3%.
(3)反应后所得溶液中溶质的质量分数为10.5%.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 111 44
12.5g×80% y z x
=10g
| 100 |
| 10g |
| 44 |
| x |
| 100 |
| 10g |
| 73 |
| y |
| 100 |
| 10g |
| 111 |
| z |
x=4.4g y=7.3g z=11.1g
所用稀盐酸中溶质的质量分数=
| 7.3g |
| (140ml-60ml)×1.25g/ml |
反应后所得溶液中溶质的质量分数=
| 11.1g |
| 10g+(140ml-60ml)×1.25g/ml-4.4g |
答:(1)生成二氧化碳的质量为4.4g.
(2)所用稀盐酸中溶质的质量分数为7.3%.
(3)反应后所得溶液中溶质的质量分数为10.5%.
点评:石灰石和稀盐酸都是混合物,不能代入化学方程式直接进行计算;化学反应都遵循质量守恒定律,根据化学方程式只能进行有关质量的计算,化学反应并不遵循体积守恒,不能将体积直接代入化学方程式进行计算.

练习册系列答案
相关题目
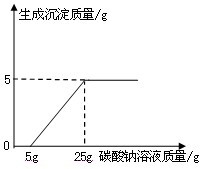 某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
某化学兴趣小组在用石灰石(杂质不与酸反应,也不溶于水)或稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他们决定利用该废液测定这瓶Na2CO3溶液的溶质质量分数.他们先将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如右图所示.
 某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)
某化学兴趣小组在实验课上制取二氧化碳气体选择了下图的发生装置.在制取完毕后有同学提出该装置还能测得稀盐酸的质量分数.小娜同学称取12.5g含CaCO380%的石灰石粉末样品置于装置中,用注射器滴加稀盐酸至恰好完全反应,滴加前后的数据如如图所示:(杂质与稀盐酸不反应,稀盐酸的密度为1.25g/mL)