题目内容
【题目】人体缺少钙元素会影响健康,因此每日需摄入足够的钙.某补钙剂和纯牛奶包装盒上的说明如图所示,请完成下列问题. 
(1)葡萄糖酸钙由种元素组成.
(2)葡萄糖酸钙碳、钙元素的质量比是 .
(3)葡萄糖酸钙的相对分子质量为 .
(4)按照该补钙剂的说明服用钙片,每天可补充mg钙元素.(结果保留小数点后1位)
(5)若人体每天至少需要0.36g钙,且这些钙有75%来自牛奶,则一个人每天至少喝盒牛奶.
【答案】
(1)四
(2)18:5
(3)430
(4)37.2
(5)1
【解析】解:(1)葡萄糖酸钙是由碳、氢、氧、钙四种元素组成的;故填:四;(2)葡萄糖酸钙中碳、钙元素的质量比是(12×12):40=18:5;故填:18:5;(3)葡萄糖酸钙的相对分子质量为(12×6+1×11+16×7)×2+40=430;故填:430;(4)根据题意,每片含葡萄糖酸钙0.2g,每日2次,每次1片,则按用量服用每天摄入钙元素的质量是0.2g×2×9.3%≈0.0372g=37.2mg.故填:37.2;(5)每盒含钙元素的质量为0.11g÷100mL×250mL≈0.28g; 人体每天至少需要来自牛奶的钙为:0.36g×75%=0.27g,
0.27g÷0.28g≈1
故需要1盒.
故填:1.

【题目】某研究小组欲检验草酸晶体样品分解产物并测定其质量分数(假设杂质不参与反应).草酸晶体(H2C2O42H2O)的理化性质见表.
(1)加热分解草酸晶体最适宜的装置是(填图1字母序号). 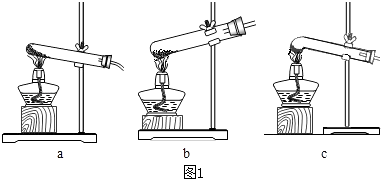
(2)图2是验证热分解产物中含CO,CO2的装置 ①仪器a和b的名称分别是和
②证明存在CO2的现象是 , 证明存在CO的现象是 , D中反应的化学方程式是 .
③装置A的作用是 , 气囊的作用是 . 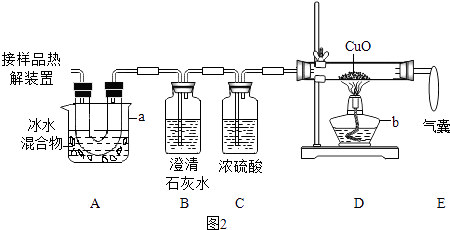
(3)为测定样品中草酸晶体的质量分数,设计两种如下方案.
熔点 | 沸点 | 热稳定性 | 与碱反应 |
101°C~102°C | 150°C~160°C升华 | 100.1°C失去结晶水,175°C分解成CO2 , CO,H2O | 与Ca(OH)2反应产生白色沉淀(CaC2O4) |
①称一定量样品用上图装置进行实验,测得装置D反应前后的质量差,由此计算出的实验结果比实际值偏低,排除仪器和操作的因素,其原因可能有:CO未完全反应、 .
②称取8.75g草酸晶体样品配制50.00g溶液,取10.00g溶液加适量的稀硫酸,然后滴加25.00g3.16%KMnO4溶液,恰好反应完全.
(已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O)则KMnO4溶液显色,25.00g3.16%KMnO4溶液中KMnO4的质量g.请计算样品中的质量分数.[写出计算过程,M2(H2C2O4)=90,M2(H2C2O42H2O)=126,M2(KMnO4)=158].