题目内容
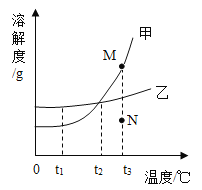
【题目】甲、乙、丙三种固体物质溶解度曲线如下图所示。下列说法错误的是( )
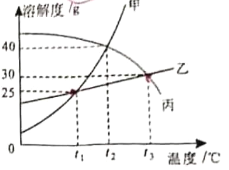
A.t1℃时,甲、乙的溶解度都是25g
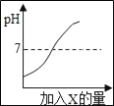
B.t1℃时,将三种物质的饱和溶液均升温到t2℃,能析出晶体的是丙
C.将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6%
D.t3℃时,将20g乙加入到50g水中充分搅拌后剩余5g乙未溶解
【答案】C
【解析】
A、由图可知,t1℃时,甲、乙的溶解度曲线相交于一点,表示t1℃时甲、乙的溶解度相同,都为25g,选项正确;
B、由图可知,甲、乙的溶解度均随温度的升高而增加,而丙的溶解度随温度升高而减小,所以t1℃时,将三种物质的饱和溶液均升温到t2℃,甲、乙的溶解度增大,溶液由饱和溶液变为不饱和溶液,而C的溶解度减小,溶液的底部有晶体析出,选项正确;
C、t1℃甲的饱和溶液的溶质质量分数=![]() ×100%=20%,甲的溶解度均随温度的升高而增加,将甲的饱和溶液从t1℃升高到t2℃时,甲的溶解度增大,溶液由饱和溶液变为不饱和溶液,溶液的溶质质量分数保持不变,仍为20%,选项错误;
×100%=20%,甲的溶解度均随温度的升高而增加,将甲的饱和溶液从t1℃升高到t2℃时,甲的溶解度增大,溶液由饱和溶液变为不饱和溶液,溶液的溶质质量分数保持不变,仍为20%,选项错误;
D、由图可知,t3℃时乙的溶解度为30g,则t3℃时,将20g乙加入到50g水中充分搅拌后只能溶解15g,剩余5g乙未溶解,选项正确,故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】化学规律建立在实验基础之上,质量守恒定律可以用许多化学实验加以验证。

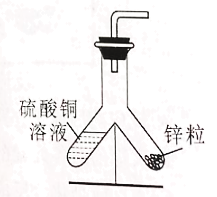
(1)小东同学按照课本上的实验进行验证(如图所示)。一段时间后,可以观察到铁钉表面出现_____,其反应的化学反应方程式为__,反应前后天平读数不变,但溶液颜色变化不明显。
(2)小东想既能验证质量守恒定律,又能更快地观察到溶液颜色的变化,提出了以下设想:
(提出设想)设想一:增大硫酸铜溶液的浓度
设想二:用更活泼的金属锌代替铁钉
(实验验证)小东将以上实验进行了如下改进:
实验内容 | 实验现象 | |
实验1 | 烧杯中换成饱和硫酸铜溶液 | ①几小时后溶液颜色几乎不变 ②天平读数不变 ③铁钉表面有变化 |
实验2 | 铁钉换成锌粒 | ①溶液颜色明显变浅 ②天平读数减小 ③锌粒表面有变化 |
(实验分析)(3)从以上现象分析,两个设想都不合适,其中按设想_____(填“一”或“二”)进行的实验能够验证质量守恒定律。
(4)实验1中溶液颜色几乎不变的原因可能是_____(填序号)。
A 铁与饱和硫酸铜溶液不反应
B 铁表面形成了一层氧化膜,阻止了反应的进一步进行
C 生成的铜快速沉积在铁表面,阻止了反应的进一步进行
D 水也参与了该反应,但饱和硫酸铜溶液中水太少
(5)实验2虽然很快观察到溶液颜色变化,但出现了反应后总质量减小的情况,老师提醒小东,硫酸铜溶液呈酸性,所以总质量减小的原因可能是____。
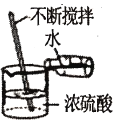
(6)小东通过反复实验和探究得出:向实验1的饱和硫酸铜溶液中加入等体积的水,将实验2中的烧杯换成如图所示装置,均能达到实验目的,但该装置中缺少一种物品,请你在装置图中画出____。