题目内容
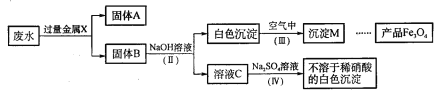
【题目】碳酸钙是一种白色固体,可溶于稀盐酸并产生无色气体。某同学想知道稀盐酸中的那种粒子(H2O、H+、Cl-)能使碳酸钙溶解并产生无色气体。请你和同学们一起通过下图所示的四个实验完成这次探究活动。
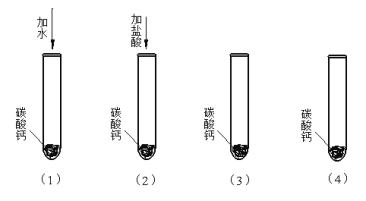
⑴你提出的假设是 ;
⑵通过实验①可以证明 ;
⑶要证明另外两种粒子能否溶解碳酸钙并产生无色气体,还需要进行实验③和④:在③和④中应分别加入 和 ;
⑷你的探究结果为 。
⑸写出实验②的化学方程式 。
【答案】⑴稀盐酸中的H+能使CaCO3溶解并产生无色气体
⑵H2O不能使CaCO3溶解并产生无色气体
⑶ 氯化钠溶液或氯化钾溶液等 硝酸等
⑷H+能使CaCO3溶解并产生无色气体
⑸ 2HCl+CaCO3===CaCl2+CO2↑+H2O
【解析】
试题分析:(1)根据化学反应的事实,提出的假设是:稀盐酸中的H+能使CaCO3溶解并产生无色气体
(2)实验①向碳酸钙中加水,结果碳酸钙不溶解,无现象,可以证明H2O不能使CaCO3溶解并产生无色气体
(3)很明显整个探究性实验的设计意图是逐一排除法与归纳总结法相结合,实验①排除了H2O,故还需排除Cl-,故实验③应加入的物质含有氯离子的可溶性盐,如氯化钠溶液或氯化钾溶液等,而实验④则是继续证明是H+,故应加入一种酸
(4)结合上面的探究过程,得出探究结果为:H+能使CaCO3溶解并产生无色气体
(5)实验②的化学方程式:2HCl+CaCO3===CaCl2+CO2↑+H2O

练习册系列答案
相关题目