题目内容
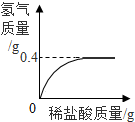 生铁是铁和碳的合金,为测定某炼铁石生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品12.0g,放入烧杯中,向其中加入146g稀盐酸时恰好完全反应,生成的氢气与加入稀盐酸的质量关系如图所示(假设杂质不参与反应),请计算:
生铁是铁和碳的合金,为测定某炼铁石生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品12.0g,放入烧杯中,向其中加入146g稀盐酸时恰好完全反应,生成的氢气与加入稀盐酸的质量关系如图所示(假设杂质不参与反应),请计算:(1)生铁样品中铁的质量分数;(结果精确到0.1%)
(2)稀盐酸中的溶质的质量分数.(结果精确到0.1%)
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:根据反应的化学方程式,由恰好完全反应时生成氢气的质量计算所消耗铁的质量和稀盐酸中氯化氢的质量;铁的质量与样品的质量比可计算生铁样品的质量分数;氯化氢的质量与稀盐酸的质量比可计算稀盐酸中的溶质的质量分数.
解答:解:由图可知,氢气的质量为0.4g
设生铁中铁的质量为x,稀盐酸中的溶质的质量为y
Fe+2HCl=FeCl2+H2↑
56 73 2
x y 0.4g
=
x=11.2g
=
y=14.6g
(1)生铁样品中铁的质量分数为:
×100%=93.3%
(2)稀盐酸中的溶质的质量分数为:
×100%=10%
答案:
(1)生铁样品中铁的质量分数93.3%
(2)稀盐酸中的溶质的质量分数为10%
设生铁中铁的质量为x,稀盐酸中的溶质的质量为y
Fe+2HCl=FeCl2+H2↑
56 73 2
x y 0.4g
| 56 |
| 2 |
| x |
| 0.4g |
x=11.2g
| 73 |
| 2 |
| y |
| 0.4g |
y=14.6g
(1)生铁样品中铁的质量分数为:
| 11.2g |
| 12g |
(2)稀盐酸中的溶质的质量分数为:
| 14.6g |
| 146g |
答案:
(1)生铁样品中铁的质量分数93.3%
(2)稀盐酸中的溶质的质量分数为10%
点评:本题考查了根据化学方程式的计算,完成此题,可以依据题干提供的数据结合铁与盐酸的反应方程式进行.

练习册系列答案
相关题目
加入适量的硫酸溶液,可使溶液中下列离子数量显著减少的是( )
| A、Cl- |
| B、Ba2+ |
| C、NO3- |
| D、Na+ |
下列对相关实验现象的描述错误的是( )
| A、在淀粉溶液中滴加碘酒后溶液变蓝 |
| B、聚乙烯在空气中灼烧有刺激性气味 |
| C、硫在空气中燃烧产生淡蓝色火焰 |
| D、在稀硫酸中滴加紫色石蕊试液后溶液变红 |

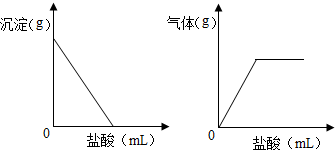 有一包色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此可以推断该包白色固体中:
有一包色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此可以推断该包白色固体中: