题目内容
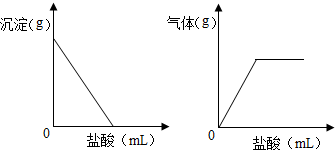 有一包色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此可以推断该包白色固体中:
有一包色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示,由此可以推断该包白色固体中:A、肯定不存在NaOH
B、可能存在Na2SO4
C、肯定存在BaCl2
D、
考点:物质的鉴别、推断,碱的化学性质,盐的化学性质
专题:混合物组成的推断题
分析:根据硫酸钠和氯化钡会生成硫酸钡沉淀,硫酸钡沉淀不溶于酸,碳酸钠和氯化钡会生成碳酸钡沉淀,碳酸钡沉淀溶于酸,氢氧化钠和酸会发生中和反应等知识进行分析.
解答:解:取样溶于水,有白色沉淀产生,在所提供的物质中相互反应能产生的沉淀有:硫酸钠与氯化钡反应生成的硫酸钡沉淀,碳酸钠与氯化钡反应生成的碳酸钡沉淀,根据图示可知生成的沉淀能溶于盐酸,并能产生气体,所以沉淀只能是碳酸钡沉淀,因为硫酸钡沉淀不溶于酸,要想生成碳酸钡必须含有碳酸钠与氯化钡,因为沉淀都能溶于酸,所以混合物中一定不存在硫酸钠,可能含有氢氧化钠,有白色沉淀生成,所以混合物中一定含有氯化钡,混合物中是否含有氢氧化钠,不会影响题中的现象,所以混合物中可能含有氢氧化钠.
故答案为:C,D、肯定存在Na2CO3.
故答案为:C,D、肯定存在Na2CO3.
点评:解答本题的关键是要知道硫酸钡沉淀不溶于酸,碳酸钡沉淀溶于酸并能产生气体.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
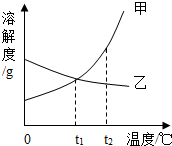 如图是甲、乙两种物质的溶解度曲线,则下列说法正确的是( )
如图是甲、乙两种物质的溶解度曲线,则下列说法正确的是( )| A、甲的溶解度大于乙的溶解度 |
| B、t1℃时,甲、乙两种物质的溶液中溶质质量分数相等 |
| C、甲、乙两种物质的饱和溶液由t2℃降到t1℃时,溶质质量分数相等 |
| D、甲中含有少量乙时,可用冷却热饱和溶液法提纯甲 |
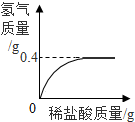 生铁是铁和碳的合金,为测定某炼铁石生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品12.0g,放入烧杯中,向其中加入146g稀盐酸时恰好完全反应,生成的氢气与加入稀盐酸的质量关系如图所示(假设杂质不参与反应),请计算:
生铁是铁和碳的合金,为测定某炼铁石生产的生铁样品中铁的质量分数,化学兴趣小组的同学称得该生铁样品12.0g,放入烧杯中,向其中加入146g稀盐酸时恰好完全反应,生成的氢气与加入稀盐酸的质量关系如图所示(假设杂质不参与反应),请计算:
 X,Y两种固体的溶解度如图.
X,Y两种固体的溶解度如图. A、B、C、D、E是初中化学中常见的5种无色气体,其中2种是单质,3种是化合物,气体E为天然气的主要成分.它们之间的转化关系如图所示,请推断,并回答有关问题.
A、B、C、D、E是初中化学中常见的5种无色气体,其中2种是单质,3种是化合物,气体E为天然气的主要成分.它们之间的转化关系如图所示,请推断,并回答有关问题.