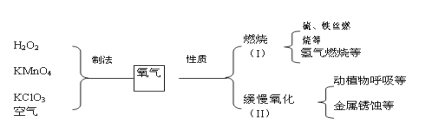
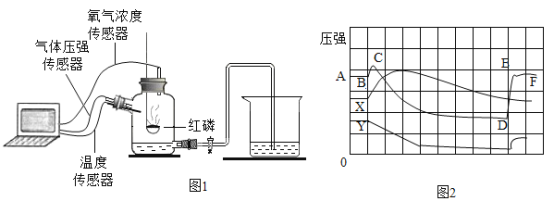
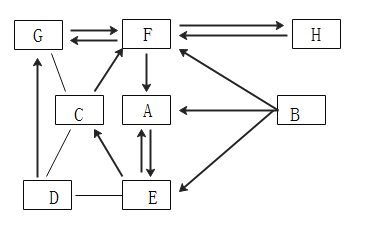
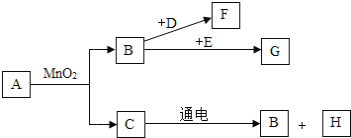
题目内容
【题目】金属铝与NaOH溶液反应的化学方程式如下:2Al+2NaOH+ 2X=2NaAlO2+3H2关于物质X,下列说法正的是( )
A.X可能含钠元素
B.X在自然界中的循环都是通过化学变化实现的
C.X是相对分子质量最小的氧化物
D.X中氧元素的质量分数为11.1%
【答案】C
【解析】
根据反应的化学方程式2Al+2NaOH+ 2X=2NaAlO2+3H2,反应物中铝、钠、氧、氢原子个数分别为2、2、2、2,反应后的生成物中铝、钠、氧、氢原子个数分别为2、2、4、6,根据反应前后原子种类、数目不变,X中含有4个氢原子和2个氧原子,则每个X分子由2个氢原子和2个氧原子构成,2X中含有4个氢原子和2个氧原子,物质X的化学式为H2O。
由分析可知:
A、X是水,X不可能含钠元素,故A错误;
B、X是水,X在自然界中的循环都是通过水的三态变化实现的,水的三态变化过程中只是物质状态发生改变,没有新物质生成,属于物理变化,故B错误;
C、水是相对分子质量最小的氧化物,故C正确;
D、X是水,X中氧元素的质量分数=![]() ,故D错误。故选C。
,故D错误。故选C。

练习册系列答案
相关题目
【题目】黄铜是铜和锌的合金。某化学兴趣小组的同学欲测定实验室中某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),请你参与他们的探究过程。称量10g粉末状黄铜样品放入烧杯中,量取45mL稀硫酸分三次加到其中,每次充分反应后,测定生成氢气的质量,实验数据如表:
第一次 | 第二次 | 第三次 | |
加入稀硫酸的体积(mL) | 15 | 15 | 15 |
生成氢气的质量(g) | m | 0.04 | 0.02 |
试求:
(1)m的数值_____。
(2)此黄铜样品中铜的质量分数是少?_____(写出计算过程)