题目内容
【题目】小华同学在用稀盐酸和氢氧化钠溶液进行中和反应实验时,测得反应过程中溶液的酸碱度变化如下图所示。
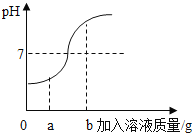
(1)该实验是将 (选填“稀盐酸”或“氢氧化钠溶液”)滴加到另一种溶液中。
(2)当加入的溶液质量为a克时,向其所得溶液中加入碳酸钠溶液,可观察到的现象为 。
(3)当加入溶液的质量为b克时,所得溶液中溶质为 (写化学式)。
(4)现有50g溶质质量分数为7.3%的稀盐酸溶液,则需要多少质量溶质质量分数为4%的氢氧化钠溶液才能恰好中和?
【答案】(1)氢氧化钠溶液
(2)有气泡产生
(3)Na Cl、NaOH
(4)100克 (计算过程略)
【解析】(1)开始溶液的 pH<7,说明原溶液是稀盐酸。(2)当加入的溶液质量为a克时, pH<7,稀盐酸剩余,当加入碳酸钠溶液时,发生反应:Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑,有气泡产生。(3)当加入溶液的质量为b克时,pH>7,氢氧化钠过量,所得溶液中溶质为NaCl、NaOH。(4)设当溶质质量分数为4%的氢氧化钠溶液的质量为x时,才能恰好中和。
NaOH + HCl=NaCl+H2O
40 36.5
x×4% 50g×7.3%
![]() =
=![]() 解得x=100克
解得x=100克

【题目】“低钠盐”可以控制钠的摄入量从而防治高血压等疾病。制备“低钠盐”是在食盐中用NaCl按照配方比例添加食用KCl。国内某些生产厂家为改变“低钠盐”口味还会加入少量镁盐(仅限MgSO4或MgCl2)。
(1)测得某“低钠盐”样品a中只含有NaCl和KCl,该样品中的NaCl和KCl溶于
水时解离出的阴离子都是___________(填离子符号)。
(2)探究某“低钠盐”样品b中是否添加有镁盐,以及添加的是何种镁盐?
【猜想】I、不含镁盐 Ⅱ、含有硫酸镁 Ⅲ、含有氯化镁

【进行实验】
(3)请完成下表(已知BaSO4是难溶于水和酸的白色固体):
假设和现象 | 判断和化学方程式 | |
① | 若现象a为白色沉淀 | 则猜想____不成立。 |
② | 若现象a为_________, 现象b为_________。 | 则猜想Ⅲ成立。写出无色溶液B与硝酸中和反 应的化学方程式_________________。 |
③ | 若现象a、b均 为:产生白色沉淀 | 则猜想____成立。写出无色溶液B与硝酸钡溶液 反应的化学方程式______________。 |


