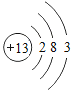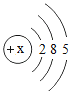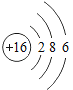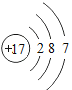题目内容
【题目】为了探究氢氧化钠与稀盐酸反应是吸热还是放热,科学兴趣小组进行如下实验:
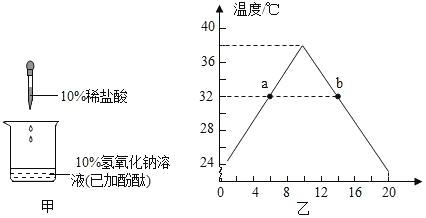
(1)图甲中,需要插入__________(填器材),通过测量__________来判断氢氧化钠和盐酸反应是吸热还是放热。
(2)氢氧化钠和盐酸恰好完全反应的评判标准是:_____。
(3)随着盐酸不断滴入,烧杯中溶液温度变化如坐标图乙所示,由此判断氢氧化钠溶液与盐酸反应是_____(选 填“吸热”或“放热”)
(4)实验过程中,测得某时溶液的温度是 32℃,则 a、b 两点的溶液中,相同的成分是_____(不包 括酚酞)。
【答案】温度计 温度变化 溶液由红色变成无色 放热 氯化钠
【解析】
(1)图甲中,需要插入温度计,通过测量温度变化来判断氢氧化钠和盐酸反应是吸热还是放热;故填:温度计;温度变化;
(2)氢氧化钠溶液显碱性,能使无色的酚酞试液变红色,滴加稀盐酸后,二者反应,溶液的碱性减弱,当二者恰好完全反应时,溶液呈中性,溶液变成无色;故填:溶液由红色变成无色;
(3)随着盐酸不断滴入,烧杯中溶液温度变化如坐标图乙所示,反应开始时温度逐渐升高,由此判断氢氧化钠溶液与盐酸反应是放热反应;故填:放热;
(4)a点所示溶液显碱性,滴加稀盐酸不足,此时溶液中的溶质是酚酞、氯化钠和氢氧化钠;b点所示溶液显酸性,滴加的稀盐酸过量,此时溶液中的溶质是酚酞、氯化钠和氯化氢;因此a、b两点的溶液中,相同的成分是氯化钠;故填:氯化钠。

 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案【题目】下表是元素周期表中第2、3周期的元素,请回答有关问题。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)下列各组具有相似化学性质的元素是_____(填字母序号);
A Na、Cl B O、S C F、Cl D Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律_____;
(3)笫8号元素与笫13号元素的原子形成化合物的化学式为_____;在该化合物中13号元素的化合价为_____;
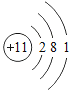
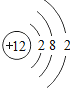
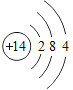
(4)某粒子的结构示意图为 ,在化学变化中易失2个电子,该粒子的符号为_____。
,在化学变化中易失2个电子,该粒子的符号为_____。
【题目】下表为元素周期表中某一周期元素的原子结构示意图。
元素名称 | 钠 | 镁 | 铝 | 硅 | 磷 | 硫 | 氯 | 氩 |
元素符号 | Na | Mg | Al | Si | P | S | Cl | Ar |
原子结构示意图 |
|
|
|
|
|
|
|
|
请回答下列问题:
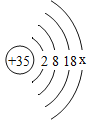
(1)表中磷原子的核电荷数x=_________,表中具有相对稳定结构的元素是_________,在化学反应中,硫原子比较容易_________(填“得到”或“失去”)电子变成离子,其离子符号为:_________。上述元素在周期表中处于同一周期的原因_________。
(2)小明同学所画的某元素的原子结构示意图如右图所示,该元素符号为Br。如图中x=_________,上表表示的微粒中,与Br化学性质相似的元素是_________。