��Ŀ����
��2007?���ݣ��ҹ�����ר�Һ�°���Ϊ�����Ƽҵ������ͻ�����ף��������Ƽ������ʳ�Ρ�������������̼��Ϊԭ�����Ƶ�N��HCq��������������������������û�ѧ����ʽ�ɼ�Ҫ��ʾΪ����NH3+H2O+CO2=NH4HCO3����NH4HCO3+NaCl=NaHCO3��+NH4Cl����2NaHCO3
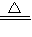 Na2CO3+H2O+CO2����
Na2CO3+H2O+CO2������1���������Ƽ�������������漰���Ļ�����Ӧ������______��
A���û���Ӧ��B�����Ϸ�Ӧ��C���ֽⷴӦ��D�����ֽⷴӦ
��2���ڢڲ��м������ĥϸ��ʳ�ηۣ�ʳ��ĥϸ��Ŀ����______��
���ڢڲ��еõ���NaHCO3�к���������NH4HCO3��������Ӱ���ƷNa2CO3�Ĵ��ȣ�ԭ����______ NH3��+H2O+CO2��
���𰸡���������1��ֻ����Ϥ���ֻ�����Ӧ���͵ĸ�����ص㣬����������ȷ���жϣ�
��2����Ӧ�����뷴Ӧ��ĽӴ������ֱ�ӹ�ϵ��
̼������ڼ����������ֽܷ��Ҳ��������
��3��ֹͣ���Ⱥ��Թ��ڵ���ѹ��Ѹ�ٽ��ͣ�
���ٵ�����������ˮ�Ͷ�����̼��������������ˮ�Ͷ�����̼���������Լ����������Ӧ��̼�����Ƶ���������������������д��������������
����⣺��1����NH3+H2O+CO2=NH4HCO3�÷�Ӧ���������ʷ�Ӧ����һ�����ʣ����ϻ��Ϸ�Ӧ�ĸ�����ڻ��Ϸ�Ӧ��
��NH4HCO3+NaCl=NaHCO3��+NH4Cl�÷�Ӧ�����ֻ����ﻥ�ཻ���ɷ��γ������µĻ�������ϸ��ֽⷴӦ�ĸ�����ڸ��ֽⷴӦ��
��2NaHCO3 Na2CO3+H2O+CO2���÷�Ӧ��һ�����ʷ�Ӧ�����������ʣ����ϷֽⷴӦ�ĸ�����ڷֽⷴӦ��
Na2CO3+H2O+CO2���÷�Ӧ��һ�����ʷ�Ӧ�����������ʣ����ϷֽⷴӦ�ĸ�����ڷֽⷴӦ��
��ˡ������Ƽ�������������漰���Ļ�����Ӧ������BCD��
��2����ʳ��ĥ��ʳ�ηۣ���������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�
����NH4HCO3 NH3��+H2O+CO2������˵ڢڲ��еõ���NaHCO3�к���������NH4HCO3ʱ����Ӱ���ƷNa2CO3�Ĵ��ȣ�
NH3��+H2O+CO2������˵ڢڲ��еõ���NaHCO3�к���������NH4HCO3ʱ����Ӱ���ƷNa2CO3�Ĵ��ȣ�
��3����Ϊ��ֹ�ձ��е�����������Һ�ص����ܵ�����ֹͣ���Ⱥ�Ӧ�Ƚ������ܴ�����������Һ��ȡ����
���������д������������Ϊx��
2NaHCO3 Na2CO3+H2O+CO2�� ���ٵ�����
Na2CO3+H2O+CO2�� ���ٵ�����
168 18 44 18+44=62
4.0g��1-x�� 20.2g+4.0g-23.5g=0.7g
 =
= ��
��
x��52.6%
�ʴ�Ϊ��
��1��BCD��
��2������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�NH4HCO3 NH3��+H2O+CO2����
NH3��+H2O+CO2����
��3�����Ƚ������ܴ�����������Һ��ȡ����
��52.6%
������������Ҫ���������Ӧ���͵��жϺ��йػ�ѧ����ʽ�ļ��㣬�ѶȽϴ�
��2����Ӧ�����뷴Ӧ��ĽӴ������ֱ�ӹ�ϵ��
̼������ڼ����������ֽܷ��Ҳ��������
��3��ֹͣ���Ⱥ��Թ��ڵ���ѹ��Ѹ�ٽ��ͣ�
���ٵ�����������ˮ�Ͷ�����̼��������������ˮ�Ͷ�����̼���������Լ����������Ӧ��̼�����Ƶ���������������������д��������������
����⣺��1����NH3+H2O+CO2=NH4HCO3�÷�Ӧ���������ʷ�Ӧ����һ�����ʣ����ϻ��Ϸ�Ӧ�ĸ�����ڻ��Ϸ�Ӧ��
��NH4HCO3+NaCl=NaHCO3��+NH4Cl�÷�Ӧ�����ֻ����ﻥ�ཻ���ɷ��γ������µĻ�������ϸ��ֽⷴӦ�ĸ�����ڸ��ֽⷴӦ��
��2NaHCO3
 Na2CO3+H2O+CO2���÷�Ӧ��һ�����ʷ�Ӧ�����������ʣ����ϷֽⷴӦ�ĸ�����ڷֽⷴӦ��
Na2CO3+H2O+CO2���÷�Ӧ��һ�����ʷ�Ӧ�����������ʣ����ϷֽⷴӦ�ĸ�����ڷֽⷴӦ����ˡ������Ƽ�������������漰���Ļ�����Ӧ������BCD��
��2����ʳ��ĥ��ʳ�ηۣ���������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�
����NH4HCO3
 NH3��+H2O+CO2������˵ڢڲ��еõ���NaHCO3�к���������NH4HCO3ʱ����Ӱ���ƷNa2CO3�Ĵ��ȣ�
NH3��+H2O+CO2������˵ڢڲ��еõ���NaHCO3�к���������NH4HCO3ʱ����Ӱ���ƷNa2CO3�Ĵ��ȣ���3����Ϊ��ֹ�ձ��е�����������Һ�ص����ܵ�����ֹͣ���Ⱥ�Ӧ�Ƚ������ܴ�����������Һ��ȡ����
���������д������������Ϊx��
2NaHCO3
 Na2CO3+H2O+CO2�� ���ٵ�����
Na2CO3+H2O+CO2�� ���ٵ�����168 18 44 18+44=62
4.0g��1-x�� 20.2g+4.0g-23.5g=0.7g
 =
= ��
��x��52.6%
�ʴ�Ϊ��
��1��BCD��
��2������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�NH4HCO3
 NH3��+H2O+CO2����
NH3��+H2O+CO2������3�����Ƚ������ܴ�����������Һ��ȡ����
��52.6%
������������Ҫ���������Ӧ���͵��жϺ��йػ�ѧ����ʽ�ļ��㣬�ѶȽϴ�

��ϰ��ϵ�д�
�����Ŀ