题目内容
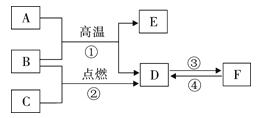
【题目】两个化学兴趣小组分别进行以下3个实验:
①MgSO4溶液和NaOH溶液反应;
②稀H2SO4和BaCl2溶液反应
③稀HCl和NaOH溶液反应(用酚酞试液作指示剂)
实验结束后,同学们发现本组废液缸里废液颜色与另一小组不一样,在征得老师同意后,两组同学各自对本小组的废液进行探究:
【提出问题】废液缸里的废液成分有什么?
【查阅资料】微溶物质在反应物中视作可溶物,在生成物中视为不溶物。
【实验探究】
(一)第1小组的探究:
1.小东首先把呈浑浊状态的废液进行分离,得红色澄清滤液和滤渣。
2.小刚认为无需进行实验,就能判断出滤渣中含有BaSO4、Mg(OH)2两种沉淀,他的理由是 ,请你写出生成其中一种沉淀的化学方程式: 。
3.小西对滤液成分(除酚酞、水外,下同)进行分析,认为滤液中一定含NaOH和NaCl,并对可能有的成分提出如下猜想:
猜想1:滤液中含有BaCl2
猜想2:滤液中含有Na2SO4
猜想3:滤液中含有BaCl2、Na2SO4
(1)小强认为猜想3是不成立的,因为 ;
(2)小雨取少量滤液于试管中,滴加 溶液,出现的现象是 ,证明猜想2成立。
(二)第2小组的探究:
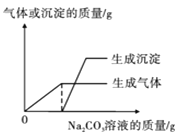
第2小组首先对废液进行了分离,得无色滤液和少量滤渣,然后取少量滤液于试管中,逐滴滴加Na2CO3溶液,并根据实验结果绘制成下图。请据此判断,滤液一定含有的离子是 (填离子符号),实验过程中滤液颜色的变化为 。
【交流反思】实验结束后,同学们一致认为实验后的废液要进行处理才能排放,否则会对环境造成污染。
【答案】(一)2.BaSO4不溶于水也不溶于酸和碱(0.5分),由题可知,由于NaOH过量,Mg2+基本上以Mg(OH)2沉淀的形式存在(0.5分)。2NaOH + MgSO4 = Na2SO4 + Mg(OH)2↓或BaCl2 + H2SO4 = BaSO4↓+ 2HCl 或 Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl 3.
(1)BaCl2、Na2SO4能相互发生化学反应,不能共存。
(2)BaCl2或Ba(NO3)2或Ba(OH)2等
产生白色沉淀(二)H+、Mg2+、Na+、Cl-(全对1分,其他答案不给分) 无色变为红色
【解析】
试题分析:(一)第1小组的探究:2、有题中叙述可知混合液显碱性,滤渣中含有BaSO4、Mg(OH)2两种沉淀,理由BaSO4不溶于水也不溶于酸和碱;由于NaOH过量, Mg2+基本上以Mg(OH)2沉淀的形式存在;生成其中一种沉淀的化学方程式:2NaOH + MgSO4 = Na2SO4 + Mg(OH)2↓或BaCl2 + H2SO4 = BaSO4↓+ 2HCl 或 Na2SO4 + BaCl2 = BaSO4↓+ 2NaCl;3、(1)小强认为猜想3是不成立的,因为BaCl2、Na2SO4能相互发生化学反应,不能共存。(2)小雨取少量滤液于试管中,滴加可溶性钡盐溶液,出现的现象是白色沉淀,证明猜想2成立。(二)第2小组的探究 加入碳酸钠溶液产生气体,说明滤液显酸性,存在氢离子;氢氧化钠和盐酸反应生成的氯化钠一定在滤液中,因此滤液中存在氯离子和钠离子;滤液能和碳酸钠反应生成沉淀,说明溶液中有镁离子或钡离子或镁离子、钡离子都有,但滤液显酸性,镁离子不形成沉淀,而酸性溶液中,钡离子和硫酸根离子能形成沉淀,所以滤液中一定有镁离子,钡离子不确定。;因为碳酸钠溶液显碱性,实验过程中滤液颜色的变化为无色变为红色。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案