题目内容
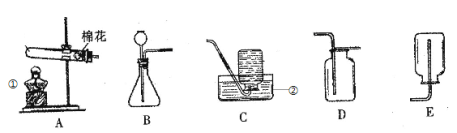
【题目】(9分)某小组同学利用如图所示装置探究铁生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。

(1)步骤一:关闭K2和K3,打开K1,A中反应的化学方程式是 ,B中所盛放的试剂是 。对比铁丝表面的变化,能够说明铁生锈与水有关的是装置 和 (填C、D或E,下同),能够说明铁生锈的快慢与氧气浓度有关的是装置 和 。
(2)步骤二:关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,两个广口瓶中现象的不同点是:① ;② ,由此也可以判断铁丝生锈情况。C中反应的化学方程式是 。
(3)温度会影响铁生锈的快慢,请设计实验加以证明: 。
【答案】(1)2H2O![]() 2H2O + O2↑ 浓硫酸 C D D E
2H2O + O2↑ 浓硫酸 C D D E
(2)①产生气泡的快慢 ②溶液的颜色 Fe +2 HCl = FeCl2 +H2↑
(3)答题要点:在氧气和水(或水蒸气浓度)相同的情况下,比较不同温度下相同的铁丝生锈的快慢
【解析】
试题分析:(1)过氧化氢分解生成水和氧气:2H2O![]() 2H2O + O2↑;铁生锈的条件是要与氧气和水接触,根据题意,把对生成的氧气进行干燥以免对实验造成干扰,故B中装的是浓硫酸,目的是干燥氧气除去水蒸汽;C装置中铁丝只与氧气接触,D装置中的铁丝与氧气和水同时接触,C装置中的铁丝没有实现而D中的生锈了,水面铁生锈的条件需要水;过氧化氢分解产生大量的氧气,而空气中的氧气的量较少,故D和E装置比较的是氧气的浓度与生锈快慢的关系;
2H2O + O2↑;铁生锈的条件是要与氧气和水接触,根据题意,把对生成的氧气进行干燥以免对实验造成干扰,故B中装的是浓硫酸,目的是干燥氧气除去水蒸汽;C装置中铁丝只与氧气接触,D装置中的铁丝与氧气和水同时接触,C装置中的铁丝没有实现而D中的生锈了,水面铁生锈的条件需要水;过氧化氢分解产生大量的氧气,而空气中的氧气的量较少,故D和E装置比较的是氧气的浓度与生锈快慢的关系;
(2)C中的铁丝没有生锈故接触到稀盐酸后会较快的产生气泡,而D装置中的铁生锈了,表面是氧化铁,滴加盐酸后盐酸先与氧化铁反应,再与铁反应,故产生气泡的速度更慢;C装置中铁与盐酸反应生成的是氯化亚铁和氢气:Fe +2 HCl = FeCl2 +H2↑;
(3)探究温度会影响铁生锈的快慢,那么要采用控制变量法,即其他的条件要完全相同,温度不同。故可去相同的铁丝在氧气和水(或水蒸气浓度)相同的情况下,比较不同温度下相同的铁丝生锈的快慢。