题目内容
【题目】海水是一种重要的自然资源,以下是对海水资源的部分利用,回答有关问题。
(1)从海水中得到金属镁——下图是从海水中提取镁的简单流程。由无水MgCl2制取Mg的化学方程式为__________________。
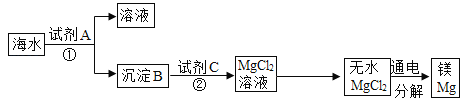
(2)海水“制碱”——下图是海水“制碱”的部分简单流程。

①步骤Ⅲ反应的化学方程式为:_______________________。
②制氨盐水的过程中要先通入氨气,再通入二氧化碳。如果反过来,二氧化碳的吸收率会降低。这是因为_____________________________。
【答案】MgCl2![]() Mg+Cl2
Mg+Cl2![]() NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 氨气溶于水形成碱性溶液,更易于吸收二氧化碳
NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl 氨气溶于水形成碱性溶液,更易于吸收二氧化碳
【解析】
(1)根据流程图可知,由无水MgCl2制取Mg的反应是氯化镁通电分解生成镁和氯气,反应的化学方程式为;MgCl2![]() Mg+Cl2
Mg+Cl2![]() ;
;
(2)①前三个步骤加入的物质有氯化钠、氨气、二氧化碳、水,这些是反应物,生成物是碳酸氢钠,由于碳酸氢钠溶解度较小,易结晶析出,应看作沉淀,方程式为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl;
②因为二氧化碳在水中溶解度比较小,直接向海水中通二氧化碳,溶解量太小;如果先通氨气,氨气溶于水形成碱性溶液,更易于吸收二氧化碳。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案【题目】某兴趣小组欲探究Al、Cu、Ag三种金属的活动性顺序,进行了如下实验:
(1)请填写实验报告:
(实验目的)探究Al、Cu、Ag三种金属的活动性顺序
(实验过程)
实验验内容 | 实验现象 | 解释或化学方程式 |
①将一根用砂纸打磨干净的铝丝放入硫酸铜溶液中 | 观察到铝丝表面有红色物质生成,溶液颜色变浅 | 用砂纸打磨铝丝的目的是________ |
②再将一根用砂纸打磨干净的铜丝放入________溶液中 | 观察到铜丝表面有银白色物质生成,溶液颜色由无色变为蓝色 | 化学方程式为_________ |
(实验结论)Al、Cu、Ag三种金属的活动性顺序由强到弱为_________;
(2)在确定了活动性后,同学们继续实验,向一定质量的硝酸银和硝酸铜的混合溶液中加入一定质量的铝粉,充分反应后过滤,得液体A和固体B。向固体B中加入稀盐酸,有气泡产生。根据此实验现象分析:所得液体A中除水外一定含有的物质是_______,固体B中一定含有的物质是_________。
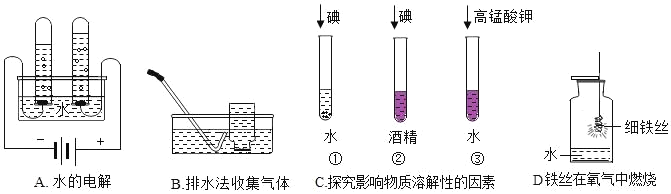
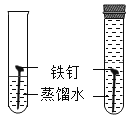
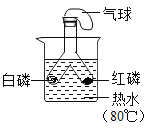
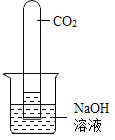
【题目】实验探究是化学学习的重要方法,下列对比实验设计能实现相应实验目的的是( )
选项 | A | B | C | D |
实验目的 | 探究铁锈蚀条件 | 探究燃烧三个条件 | 证明CO2与NaOH反应 | 探究分子运动 |
实验设计 |
|
|
|
|
A.AB.BC.CD.D