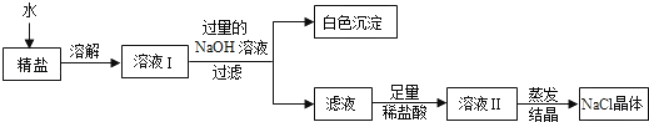
题目内容
【题目】为研究酸和碱反应的特点,将稀盐酸匀速、缓慢地滴入盛有氢氧化钠溶液的烧杯中,并测绘出烧杯内溶液的温度和pH的变化图像(如图所示),请回答问题:
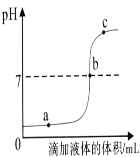
(1)由pH变化图像可知,在t1时刻,烧杯中存在的阴离子是_______(写离子符号)。
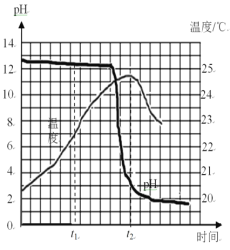
(2)由温度变化图像可知,稀盐酸和氢氧化钠溶液发生的化学反应是______(选填“放热”或“吸热”)反应。t2时刻后,溶液温度降低的主要原因是______。
(3)上述实验产物为氯化钠,实验小组还想测量一定质量大颗粒食盐晶体的体积。在量筒内倒入一定量的水,然后将一定质量的食盐晶体放入,观察液面的变化来测量食盐的体积,但他的想法马上遭到大家的否定,原因是______。最后同学换成另一种液体才取得实验成功。
【答案】Cl-,OH- 放热 完全反应后溶液向外散热,过量的稀盐酸对烧杯内的溶液进行冷却 食盐易(能)溶于水
【解析】
(1)NaOH+HCl==NaCl+H2O,由pH变化图像可知,在t1时刻时,溶液的pH>12,溶液显碱性,所以烧杯中存在的溶质有生成的NaCl、剩余的NaOH,烧杯中存在的阴离子是Cl-,OH-。
(2)由温度变化图像可知,随着反应的进行,溶液的温度逐渐升高,所以稀盐酸和氢氧化钠溶液发生的化学反应是放热反应。t2时刻后,溶液温度降低的主要原因是完全反应后不再产生热量,并且溶液向外散热,过量的稀盐酸对烧杯内的溶液进行冷却。
(3)食盐易(能)溶于水,构成食盐的钠离子、氯离子运动到水分子的间隔中去了。

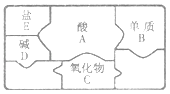
【题目】甲、乙、丙、丁四种物质的相互反应关系如图所示,“—”表示相连的物质间能发生反应,下列符合对应反应关系的选项是

选项 | A | B | C | D | |
物 质 | 甲 | Ca(OH)2 | CO2 | H2 | Mg |
乙 | Na2CO3 | NaOH | O2 | HCl | |
丙 | H2SO4 | CaCl2 | CuO | CuSO4 | |
丁 | BaCl2 | K2CO3 | HCl | NaOH | |
A. AB. BC. CD. D