题目内容
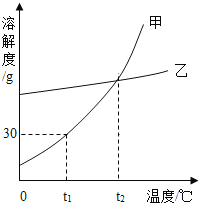
【题目】如图为甲、乙两种固体的溶解度曲线。下列说法正确的是(_____)
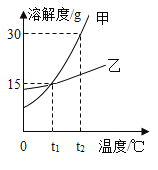
A甲物质的溶解度比乙大
B将接近饱和的甲溶液变为饱和溶液,可采用蒸发溶剂或降温的方法
Ct1°C时,甲、乙两种物质的饱和溶液中,溶质质量分数均为15%
Dt2°C时,将20g甲物质放入50g水中,所得溶液的质量为______________g
【答案】B 65
【解析】
A、不确定温度,不能比较甲、乙两种物质的溶解度大小;故选项错误;
B、甲物质的溶解度随着温度的升高而增大,将接近饱和的甲溶液变为饱和溶液,可采用蒸发溶剂或降温或加溶质的方法;故选项正确;
C、t1°C时,甲、乙两种物质的饱和溶液中,溶质质量分数=![]() ;故选项错误;
;故选项错误;
故选:B。
D、t2°C时,甲物质的溶解为30g,将20g甲物质放入50g水中,最多溶解15g固体甲,所得溶液的质量为15g+50g=65g。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】为测定某样品中锌的质量分数,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设锌的样品中杂质不与稀硫酸反应,且不溶于水),每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀硫酸恰好完全反应的是上表中第________次操作;
(2)计算样品中锌的质量分数; ____
(3)计算实验中所用稀硫酸的溶质质量分数。 ______