题目内容
亮亮到野山谷旅游时,带回一瓶泉水,在老师的指导下,按图1流程进行实验,制取蒸馏水.请回答下列问题:
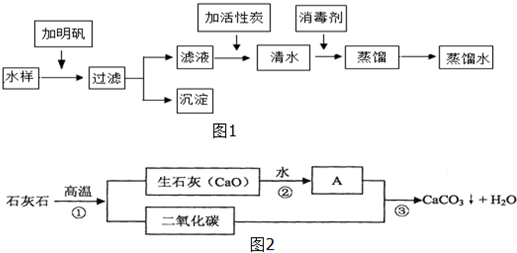
(1)取水后加入明矾的作用是 .
(2)进行过滤操作时,下列做法错误的是
A.玻璃棒要靠在三层滤纸的一边 B.漏斗下端的管口要紧靠烧杯的内壁
C.滤纸的边缘要低于漏斗口 D.液面不要低于滤纸边缘
(3)向滤液中加入活性炭,利用其 ,除去水样中的色素和异味.
(4)消毒剂高铁酸钠 (Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化.高铁酸钠中铁元素的化合价为 价.
(5)水是常用的溶剂,也可作反应物.某品牌牙膏中的摩擦剂是经过一系列加工而制得的极细小的碳酸钙粉末,它的生产过程如图2:
Ⅰ、请写出A物质的名称 .
Ⅱ、请写出反应③的化学方程式 .

(1)取水后加入明矾的作用是
(2)进行过滤操作时,下列做法错误的是
A.玻璃棒要靠在三层滤纸的一边 B.漏斗下端的管口要紧靠烧杯的内壁
C.滤纸的边缘要低于漏斗口 D.液面不要低于滤纸边缘
(3)向滤液中加入活性炭,利用其
(4)消毒剂高铁酸钠 (Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化.高铁酸钠中铁元素的化合价为
(5)水是常用的溶剂,也可作反应物.某品牌牙膏中的摩擦剂是经过一系列加工而制得的极细小的碳酸钙粉末,它的生产过程如图2:
Ⅰ、请写出A物质的名称
Ⅱ、请写出反应③的化学方程式
考点:水的净化,过滤的原理、方法及其应用,碳酸钙、生石灰、熟石灰之间的转化,碳单质的物理性质及用途,有关元素化合价的计算,书写化学方程式、文字表达式、电离方程式
专题:空气与水,常见的盐 化学肥料
分析:(1)据明矾的作用分析解答;
(2)据过滤的操作注意事项分析解答;
(3)活性炭具有吸附性,能吸附色素和异味;
(4)在化合物中各元素正负化合价的代数和为零;
(5)氧化钙能与水反应生成氢氧化钙;二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水.
(2)据过滤的操作注意事项分析解答;
(3)活性炭具有吸附性,能吸附色素和异味;
(4)在化合物中各元素正负化合价的代数和为零;
(5)氧化钙能与水反应生成氢氧化钙;二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水.
解答:解:(1)明矾溶于水形成的胶体能吸附水中的悬浮杂质,使杂质沉降来达到净水的目的;
(2)A.玻璃棒要靠在三层滤纸的一边,正确;
B.漏斗下端的管口要紧靠烧杯的内壁,正确;
C.滤纸的边缘要低于漏斗口,正确;
D.液面要低于滤纸边缘,错误;
(3)活性炭具有吸附性,能吸附水中的色素和异味;
(4)Na2FeO4中钠元素的化合价为+1,氧元素的化合价为-2,设铁元素的化合价为x,则有(+1)-2+x+(-2)×4=0,解得x=+6;
(5)Ⅰ氧化钙能与水反应生成氢氧化钙;
Ⅱ二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水
故答案为:(1)溶于水后生成的胶状物吸附杂质,从而使杂质沉降;
(2)D;
(3)吸附性;
(4)+6;
(5)Ⅰ氢氧化钙;
ⅡCa(OH)2+CO2=CaCO3↓+H2O
(2)A.玻璃棒要靠在三层滤纸的一边,正确;
B.漏斗下端的管口要紧靠烧杯的内壁,正确;
C.滤纸的边缘要低于漏斗口,正确;
D.液面要低于滤纸边缘,错误;
(3)活性炭具有吸附性,能吸附水中的色素和异味;
(4)Na2FeO4中钠元素的化合价为+1,氧元素的化合价为-2,设铁元素的化合价为x,则有(+1)-2+x+(-2)×4=0,解得x=+6;
(5)Ⅰ氧化钙能与水反应生成氢氧化钙;
Ⅱ二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水
故答案为:(1)溶于水后生成的胶状物吸附杂质,从而使杂质沉降;
(2)D;
(3)吸附性;
(4)+6;
(5)Ⅰ氢氧化钙;
ⅡCa(OH)2+CO2=CaCO3↓+H2O
点评:本题考查了净水的知识,完成此题,可以依据已有的知识进行分析解答.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
下列有关金属和合金的说法正确的是( )
| A、钛和钛合金与人体有很好的相容性,可用来制人造骨 |
| B、“防盗玻璃”结构中嵌有极细的金属线,它能报警是利用了金属的延展性 |
| C、锌的化学性质比铁活泼,铁的表面镀锌不能防止生锈 |
| D、合金要比组成它的纯金属的熔点高、硬度大 |
 将质量相等的a、b、c三块金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如图所示(产物中a、b、c三种元素的化合价相同).分析图,可以获得:
将质量相等的a、b、c三块金属,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系如图所示(产物中a、b、c三种元素的化合价相同).分析图,可以获得: