题目内容
家用蒸馒头用的纯碱中含有少量的氯化钠.课外探究小组的同学欲测定某纯碱中碳酸钠的质量分数,他们取该纯碱样品11.0g,全部溶解在100.0g水中,再加入氯化钙溶液141.0g,恰好完全反应.过滤后得到滤液242g,请计算:
(1)过滤干燥后,得到沉淀的质量为 g.
(2)纯碱中碳酸钠的质量分数.
(1)过滤干燥后,得到沉淀的质量为
(2)纯碱中碳酸钠的质量分数.
考点:根据化学反应方程式的计算
专题:有关化学方程式的计算
分析:(1)根据质量守恒定律可以求出沉淀的质量;
(2)根据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钙发生反应,碳酸钠与氯化钙生成碳酸钙沉淀和氯化钠,根据生成沉淀碳酸钙的质量可计算样品中所含碳酸钠的质量;
(2)根据氯化钠、碳酸钠的性质,氯化钠不能与加入的氯化钙发生反应,碳酸钠与氯化钙生成碳酸钙沉淀和氯化钠,根据生成沉淀碳酸钙的质量可计算样品中所含碳酸钠的质量;
解答:解:
(1)根据质量守恒定律,沉淀的质量为:11g+100g+141g-242g=10g
(2)设恰好完全反应时参加反应的碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10g
=
x=10.6g
纯碱中碳酸钠的质量分数
×100%=96.4%
答案:
(1)10
(2)纯碱中碳酸钠的质量分数 96.4%
(1)根据质量守恒定律,沉淀的质量为:11g+100g+141g-242g=10g
(2)设恰好完全反应时参加反应的碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 10g
| 106 |
| x |
| 100 |
| 10g |
x=10.6g
纯碱中碳酸钠的质量分数
| 10.6g |
| 11g |
答案:
(1)10
(2)纯碱中碳酸钠的质量分数 96.4%
点评:根据化学方程式可以表示反应中各物质的质量关系,由其中任意一种物质的质量可计算反应中其它物质的质量.

练习册系列答案
相关题目
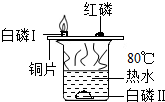 某同学为探究物质燃烧条件,设计并完成如图所示实验,根据如图所示的实验现象,下列对此实验的判断与认识中不正确的是( )
某同学为探究物质燃烧条件,设计并完成如图所示实验,根据如图所示的实验现象,下列对此实验的判断与认识中不正确的是( )| A、物质燃烧必须要与氧气(或空气)接触 |
| B、物质燃烧温度必须要达到着火点 |
| C、烧杯中热水的作用只起提高温度的作用 |
| D、铜片上的白磷与红磷的着火点不同,则现象不同 |
下列实例中,属于内能转化为机械能的是( )
| A、锯钢管时锯条发热 |
| B、燃放节日礼花,礼花腾空而起 |
| C、萤火虫发光 |
| D、水力发电 |

 某化学小组同学要测定某石灰石样品中碳酸钙的质量分数,进行如下实验:取25g石灰石样品放入烧杯,然后向里面逐滴加入一定质量、某溶质质量分数的稀盐酸,直至与样品充分反应(杂质不反应).产生二氧化碳质量随反应时间的变化关系如图所示.请分析并完成下列问题:
某化学小组同学要测定某石灰石样品中碳酸钙的质量分数,进行如下实验:取25g石灰石样品放入烧杯,然后向里面逐滴加入一定质量、某溶质质量分数的稀盐酸,直至与样品充分反应(杂质不反应).产生二氧化碳质量随反应时间的变化关系如图所示.请分析并完成下列问题: 化学是研究物质的组成、结构、性质以及变化规律的科学.通过近一年的学习,对于水,你一定很熟悉,请回答下面的问题:
化学是研究物质的组成、结构、性质以及变化规律的科学.通过近一年的学习,对于水,你一定很熟悉,请回答下面的问题: 某化学小组的同学对碳酸氢钠(NaHCO3)的性质进行探究.
某化学小组的同学对碳酸氢钠(NaHCO3)的性质进行探究.