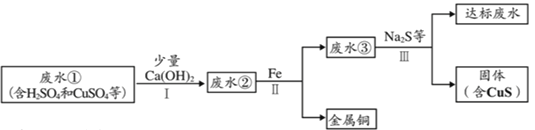
题目内容
【题目】某化学兴趣小组在实验室用碳酸钠溶液和熟石灰固体制取少量氢氧化钠溶液.他们的实验过程和相关数据如图所示.请计算: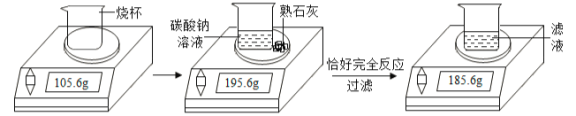
(1)实验中生成沉淀的质量为 g;
(2)求碳酸钠溶液中的溶质的质量。(写出解题过程)
(3)若反应后滤液中的溶质质量为M,则所得滤液的溶质质量分数的计算式可表示为 (列出含M的计算式即可)。
【答案】(1)10;(2)10.6g;(3)M ÷(185.6-105.6)×100%
【解析】根据质量守恒定律及化学方程式的计算解答。
解:(1)实验中生成沉淀的质量为195.6g-185.6g=10g。
(2)设碳酸钠溶液中的溶质的质量为x。
Na2CO3 + Ca(OH)2 == CaCO3 ↓+2NaOH
106 100
x 10g
![]()
x=10.6g
(3)反应所得滤液的质量=185.6g-105.6g
故所得滤液的溶质质量分数的计算式可表示为: ![]()
答:(2)碳酸钠溶液中的溶质的质量为10.6g;
(3)所得滤液的溶质质量分数的计算式可表示为: ![]() 。
。

【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定了反应后溶液的pH,得到了如下图所示的pH曲线,请回答:
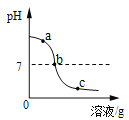
(1)由图可知该实验操作是将__________滴加到另一种溶液中;
(2)该反应的化学方程式为___________;
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了作标记,请你设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3=CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现___________的现象。结论:该样品是a处溶液。
②为进一步确定b或c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液。 | ________ | 该样品为b处溶液。 |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑____________。