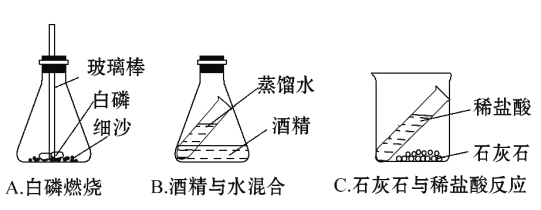
题目内容
【题目】燃煤锅炉尾气中含有较多的SO2,用石灰水吸收SO2后生成的CaSO3和CaSO4可用于化工生产。若这两种物质的混合物中钙元素的质量分数为30%,则其中含CaSO4的质量分数为
A. 46% B. 51% C. 56% D. 85%
【答案】D
【解析】
根据题意,在CaSO3和CaSO4的混合物中钙元素的质量分数为30%,可设硫酸钙的质量分数为x,混合物的质量为100g,然后由化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
CaSO3中钙元素的质量分数=![]() ,CaSO4中钙元素的质量分数=
,CaSO4中钙元素的质量分数=![]() 。
。
设:硫酸钙的质量分数为x,混合物的质量为100g;
则:100g×(1-x)×![]() +100g×x×
+100g×x×![]() 40=100g×30% ,解得 x=85%,故选D。
40=100g×30% ,解得 x=85%,故选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目