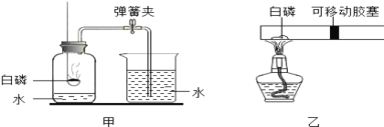
题目内容
【题目】(1)矿物质水中元素及国标含量如下表所示,请回答下列问题。

①矿物质水中含有_______种非金属元素;
②久置的水中会溶有一定量的氧气。请写出两个氧分子___________;
③表中的一种阴离子_____________;
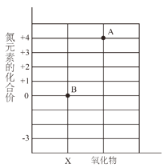
④偏硅酸(H2SiO3)中硅元素的化合价为_______价。
(2)现有H、O、Al、N四种常见的元素,请选用其中的元素写出符合下列要求的物质各一种(用化学式表示)
①制硝酸和氮肥的重要原料是_________;②一种含有金属元素的氧化物是________;
③常用来炼钢的气体是_________________;④相对分子质量最小的氧化物是________。
【答案】5 2O2 Cl- 或SO42-或SiO32- +4 N2 Al2O3 O2 H2O
【解析】
(1)①根据元素的分类方法进行分析;
②分子的表示方法,正确书写物质的化学式,表示多个该分子,在其分子符号前加上相应的数字;
③表中的阴离子有硫酸根离子、氯离子等,写出其离子符号即可;
④根据在化合物中,正负化合价的代数和为零分析;
(2)根据物质的用途、性质确定物质,再书写化学式。
(1)①由矿物质水中主要成分可知,矿物质水中含有种非金属元素有硅、硫、氢、氧、氯五种元素;
②分子的表示方法是正确书写物质的化学式,表示多个该分子,在其化学式前加上相应的数字,则两个氧分子可表示为:2O2;
③带负电的原子或原子团为阴离子,故表中的阴离子有硫酸根离子、氯离子、亚硫酸根离子等,其符号为:Cl- 或SO42-或SiO32-;
④在偏硅酸(H2SiO3)中,氢元素显+1价。氧元素显-2价,设:偏硅酸中硅元素的化合价为x,根据在化合物中正负化合价代数和为零,则有:(+1)×2+x+(-2)×3=0,则x=+4;
(2)①制硝酸和氮肥的重要原料是氮气,化学式是N2;②一种含有金属元素的氧化物是氧化铝,化学式是Al2O3;③常用来炼钢的气体是氧气,化学式是O2;④相对分子质量最小的氧化物是水,化学式是H2O。

 名校课堂系列答案
名校课堂系列答案【题目】根据如图回答问题:
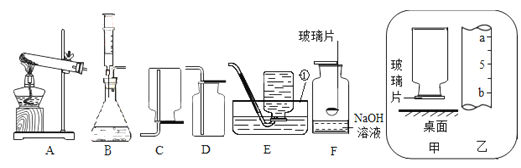
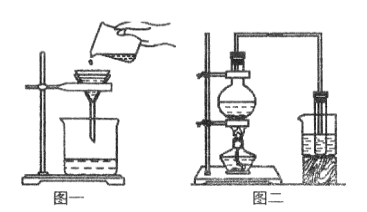
(1)写出图中标号仪器名称:①__________ 。
(2)实验室用高锰酸钾制取并收集一瓶比较干燥的氧气,应选用的装置组合为_______(填字母,从装置A--E中选择),还缺少一种实验用品__________,其作用为_______。写出高锰酸钾制氧气的化学方程式______。
(3)某兴趣小组在实验室用B装置来制取氧气,发生反应的化学方程式为____,反应后要回收二氧化锰固体,应对反应后的混合物进行的实验操作是______、洗净、干燥。
(4)用F装置做硫在氧气中的燃烧实验,燃烧结束后取出燃烧匙,立即用玻璃片盖住瓶口并振荡,若将集气瓶倒转,发现玻璃片被“吸住”而不掉下来(如图甲),则F装置中NaOH溶液的作用是________。为了完成上述实验,用l0mL量筒量取6mL的NaOH溶液,读数时量筒内液体的凹液面最低处应与乙图中_______处(填“a”或“b”)刻度线保持水平。
(5)我们知道氧气能使带火星的木条复燃,那么使带火星的木条复燃是否一定需要纯氧呢?为了弄清这个问题,某化学探究小组进行了如下探究:
Ⅰ.取5个大小相同的集气瓶,分别编号1、2、3、4、5,并分别使瓶内留有占集气瓶10%、20%、30%、40%、50%的水(余下的为空气),用玻璃片盖住,并倒扣于装有水的水槽中。
Ⅱ.分别用排水法向上述5个瓶中通入氧气,小心把5个瓶内的水排完用玻璃片盖住瓶口,取出正立放好。
编号 | 1 | 2 | 3 | 4 | 5 |
现象 | 微亮 | 亮 | 很亮 | 复燃 | 复燃 |
Ⅲ.分别将带火星的木条伸入5个瓶中,现象如下:
根据实验回答下列问题
①从观察到的现象可知,使带火星的木条复燃所需氧气的最小体积介于______ 号瓶和______号瓶之间。
②用排水法收集氧气后,4号瓶中氧气的体积分数约为________。