题目内容
已知CaCO3+H2O+CO2=Ca(HCO3)2,Ca(HCO3)2易溶于水.某实验小组在含一定量Ca(OH)2的石灰水中通入CO2,产生沉淀的量与通入CO2气体的量的关系如图所示,回答下列问题: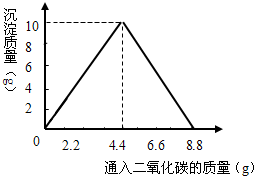
(1)写出石灰水中刚通入CO2时的化学方程式
(2)至少通入
(3)请描述整个实验过程的现象
分析:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据质量守恒定律的两个原则.
二氧化碳能使全部的氢氧化钙转化为碳酸钙沉淀,此时继续通入二氧化碳,生成的碳酸钙沉淀与二氧化碳和水反应生成可溶性的碳酸氢钙,当碳酸钙全部转化为碳酸氢钙时,溶液质量达到最大值.由图示的数据根据化学方程式可以计算出需要二氧化碳的质量.
二氧化碳能使全部的氢氧化钙转化为碳酸钙沉淀,此时继续通入二氧化碳,生成的碳酸钙沉淀与二氧化碳和水反应生成可溶性的碳酸氢钙,当碳酸钙全部转化为碳酸氢钙时,溶液质量达到最大值.由图示的数据根据化学方程式可以计算出需要二氧化碳的质量.
解答:解:(1)二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水.
该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
(2)由图示可知生成沉淀的质量为10g.
设生成10g需要二氧化碳的质量为x.
Ca(OH)2+CO2=CaCO3↓+H2O
44 100
x 10g
=
,x=4.4g
设10g沉淀完全反应需要二氧化碳的质量为y.
CaCO3+H2O+CO2=Ca(HCO3)2
100 44
10g y
=
,y=4.4g
共需要二氧化碳的质量为
4.4g+4.4g=8.8g
(3)整个过程的现象是:开始产生白色沉淀,随着CO2的不断通入沉淀逐渐增多,然后沉淀不断减少,最后完全消失.(或者写溶液先变浑浊后又变澄清)
故答案为:
(1)Ca(OH)2+CO2═CaCO3↓+H2O;
(2)8.8;
(3)开始产生白色沉淀,随着CO2的不断通入沉淀逐渐增多,然后沉淀不断减少,最后完全消失.(或者写溶液先变浑浊后又变澄清)
该反应的化学方程式为:Ca(OH)2+CO2=CaCO3↓+H2O.
(2)由图示可知生成沉淀的质量为10g.
设生成10g需要二氧化碳的质量为x.
Ca(OH)2+CO2=CaCO3↓+H2O
44 100
x 10g
| 44 |
| 100 |
| x |
| 10g |
设10g沉淀完全反应需要二氧化碳的质量为y.
CaCO3+H2O+CO2=Ca(HCO3)2
100 44
10g y
| 100 |
| 44 |
| 10g |
| y |
共需要二氧化碳的质量为
4.4g+4.4g=8.8g
(3)整个过程的现象是:开始产生白色沉淀,随着CO2的不断通入沉淀逐渐增多,然后沉淀不断减少,最后完全消失.(或者写溶液先变浑浊后又变澄清)
故答案为:
(1)Ca(OH)2+CO2═CaCO3↓+H2O;
(2)8.8;
(3)开始产生白色沉淀,随着CO2的不断通入沉淀逐渐增多,然后沉淀不断减少,最后完全消失.(或者写溶液先变浑浊后又变澄清)
点评:本题主要考查化学方程式的书写和有关多步反应的化学方程式的计算,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

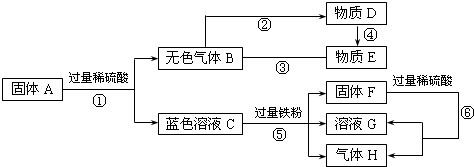
 (用化学方程式表示)
(用化学方程式表示)
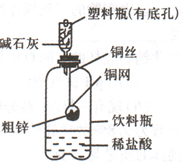 某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.按下列实验步骤进行,请填写相关内容.
某化学兴趣小组拟用右图装置对某粗锌样品进行纯度检测.按下列实验步骤进行,请填写相关内容.