题目内容
将黑色粉末A和无色液体B混合,生成一种无色无味的气体C;加热暗紫色固体E,可同时得到A和C;无色气体C能使带火星的木条复燃.若将银白色金属丝D点燃后放入盛有气体C的集气瓶中,D剧烈燃烧,火星四射,生成一种黑色固体F,并放出大量的热.
(1)试据此推断并写出A、B、C、D、E、F各物质的化学式:
A
(2)写出下列有关反应的化学方程式:
A与B混合有C生成:
D在C中燃烧生成F:
(1)试据此推断并写出A、B、C、D、E、F各物质的化学式:
A
MnO2
MnO2
、BH2O2
H2O2
、CO2
O2
、DFe
Fe
、EKmnO4
KmnO4
、FFe3O4
Fe3O4
(2)写出下列有关反应的化学方程式:
A与B混合有C生成:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
| ||
D在C中燃烧生成F:
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
分析:(1)由“无色气体C能使带火星的木条复燃”为推断入口,得知C是氧气;然后通过D和氧气的反应现象推得F是四氧化三铁,D是铁;进而推得A、B、E各是什么物质了.
(2)正确推测出各物质,正确书写化学方程式.
(2)正确推测出各物质,正确书写化学方程式.
解答:解:(1)由“无色气体C能使带火星的木条复燃”为推断入口,得知C是氧气;然后通过D和氧气的反应现象推得F是四氧化三铁,D是铁;由黑色粉末A和无色液体B混合,生成氧气,根据生成氧气的实验室制法推得A为二氧化锰,B溶液为过氧化氢溶液;由加热暗紫色固体E,可同时得到二氧化锰和氧气,推得E为高锰酸钾.
(2)写出下列有关反应的化学方程式:
A与B混合有C生成:2H2O2
2H2O+O2↑;D在C中燃烧生成F:3Fe+2O2
Fe3O4.
故答案为:(1)A:MnO2、B:H2O2、C:O2、D:Fe、E:KmnO4、F:Fe3O4
(2)2H2O2
2H2O+O2↑;3Fe+2O2
Fe3O4
(2)写出下列有关反应的化学方程式:
A与B混合有C生成:2H2O2
| ||
| ||
故答案为:(1)A:MnO2、B:H2O2、C:O2、D:Fe、E:KmnO4、F:Fe3O4
(2)2H2O2
| ||
| ||
点评:推断习题要善于根据习题中的信息来寻找突破口,抓住解决问题的关键,比如本题中的“无色气体C能使带火星的木条复燃”既是解决此题的关键突破口.当然学生还得有过硬的基础知识根基.

练习册系列答案
相关题目

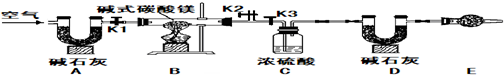

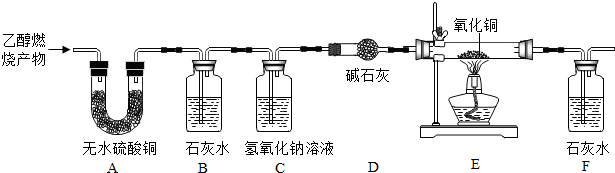
 “实验探究,培养创新精神”一直是我们的追求,愿同学们动脑筋、善于总结、大胆实验,现有一套如图简易装置,请大家小组合作探究.(B处实验药品根据需要自己选择)
“实验探究,培养创新精神”一直是我们的追求,愿同学们动脑筋、善于总结、大胆实验,现有一套如图简易装置,请大家小组合作探究.(B处实验药品根据需要自己选择)