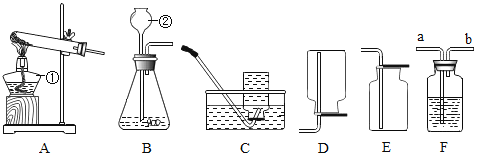
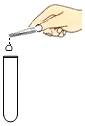
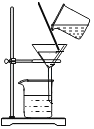
题目内容
【题目】化学实验小组的同学们对催化剂产生了兴趣,通过查阅资料了解到氧化铁也能加速氯酸钾的分解。为了探究氧化铁能否加快过氧化氢的分解,他们设计了实验装置,并进行气体的制备和测量实验,实验时均以生成40mL气体为标准,相关实验数据记录如下表:
实验序号 | 过氧化氢溶液浓度/% | 过氧化氢溶液体积/mL | 过氧化氢溶液温度/℃ | 氧化铁的用量/g | 收集40mL氧气 所需时间/s |
① | 5 | 10 | 20 | 0 | 128.5 |
② | 5 | 10 | 20 | 1.2 | 16.8 |
③ | 15 | 10 | 20 | 1.2 | 10.5 |
④ | 5 | 10 | 70 | 0 | 32.7 |
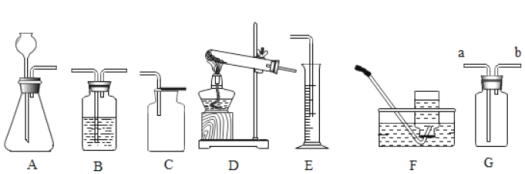
(1)若用氯酸钾和二氧化锰制氧气可选用的发生装置_____(填字母)该反应的化学方程式_____。若用过氧化氢制氧气的发生装置是_____(填字母)
(2)通过实验①和④对比可知,化学反应速率与温度的关系是_____;通过实验②和③对比可知,化学反应速率与_____有关:通过实验_____和_____(填表中的序号)对比可知,氧化铁可以加快过氧化氢分解制氧的速率。
(3)若要证明氧化铁是过氧化氢分解的催化剂,还需要验证它在该反应前后的_____和_____未发生改变。
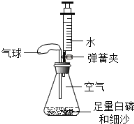
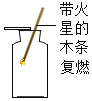
(4)G图装置也能收集气体,若收集氢气,应从_____(“a”或”b”下同)端通入氢气:若检验氧气是否收集满,应将燃着的木条放在_____端。
【答案】D; 2KClO3![]() 2KCl+3O2↑; A; 温度越高,反应速率越快; 反应物浓度; ①; ②; 质量; 化学性质; b; b
2KCl+3O2↑; A; 温度越高,反应速率越快; 反应物浓度; ①; ②; 质量; 化学性质; b; b
【解析】
(1)用氯酸钾和二氧化锰制氧气属于固体加热型,所以选择装置D来制取,氯酸钾在二氧化锰作催化剂、加热的条件下分解为氯化钾和氧气;用过氧化氢制氧气属于固液常温型,选择装置A来制取;故填:D;2KClO3![]() 2KCl+3O2↑;A;
2KCl+3O2↑;A;
(2)通过实验①和④对比可知,化学反应速率与温度的关系是温度越高,反应速率越快;通过实验②和③对比可知,化学反应速率与反应物浓度有关;通过实验 ①和 ②对比可知,氧化铁可以加快过氧化氢分解放氧的速率。故填:温度越高,反应速率越快;反应物浓度;①;②;
(3)催化剂在化学反应前后的质量不变,故要证明氧化铁是过氧化氢分解的催化剂,还需要验证它在该反应前后的质量和化学性质未发生改变;故填:质量;化学性质;
(4)氢气的密度比空气小,所以用装置G来收集氢气时,氢气应从短管进入;氧气的密度比空气大,用装置G收集氧气时,氧气从长管进入,验满时将带火星的木条放在短导管b处,观察木条是否复燃即可;故填:b;b。

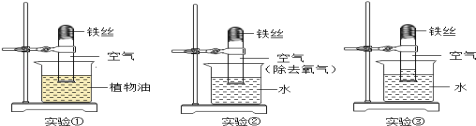
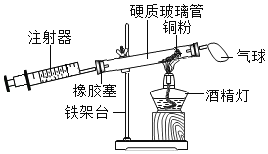
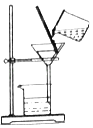
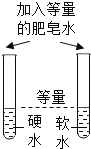
【题目】为了达到相应的实验目的,某兴趣小组同学设计了以下四个实验,其中不能够成功的是( )
A.证明氧气已集满 | B.测定空气中氧气的含量 | C.分离制取氧气后固液混合物 | D.区分硬水和软水 |
|
|
|
|
A. AB. BC. CD. D