题目内容
 某化学兴趣小组的同学将CO2通入澄清石灰水时发现石灰水先变浑浊后又变澄清了,查阅资料后发现:CaCO3+CO2+H2O=Ca(HCO3)2,Ca(HCO3)2是可以溶于水的,所以生成的沉淀又消失了.兴趣小组的同学将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的质量为0.44g(忽略CO2溶于水的情况).
某化学兴趣小组的同学将CO2通入澄清石灰水时发现石灰水先变浑浊后又变澄清了,查阅资料后发现:CaCO3+CO2+H2O=Ca(HCO3)2,Ca(HCO3)2是可以溶于水的,所以生成的沉淀又消失了.兴趣小组的同学将KCl和Ca(OH)2混合物1.86g全部溶于一定量水中形成稀溶液,再缓缓通入足量的CO2气体.当生成沉淀的质量刚好最大时,消耗CO2的质量为0.44g(忽略CO2溶于水的情况).(1)原混合物中Ca(OH)2的质量为
0.74
0.74
g.(2)写出溶液中生成沉淀的质量Y(g)与通入CO2的质量X(g)之间的函数表达式
①
25X=11Y
25X=11Y
;(0g≤X≤0.44g) ②
25X+11Y=22
25X+11Y=22
;(0.44g≤X≤0.88g)(3)在图示坐标系上,画出生成沉淀的质量m(g)与通入CO2 的质量M(g)的关系曲线.
分析:(1)根据二氧化碳的质量计算出消耗的氢氧化钙的质量;(2)根据二氧化碳的取值由0到0.44g为变量,设二氧化碳的质量为X,生成沉淀质量Y通过方程式写出比例式,求出二者关系,计算时要注意二氧化碳通过量后还能发生另一种化学反应;(3)取极值法求出最大值和最小值,进行连线.
解答: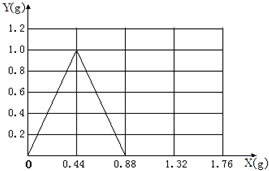 解:(1)设与0.44g二氧化碳反应消耗氢氧化钙的质量为z,生成沉淀质量为w则:
解:(1)设与0.44g二氧化碳反应消耗氢氧化钙的质量为z,生成沉淀质量为w则:
CO2+Ca(OH)2═CaCO3↓+H2O
44 74 100
0.44g z w
=
=
解得z=0.74g w=1g.
(2)①CO2+Ca(OH)2═CaCO3↓+H2O
44 100
X Y
=
Y=
,即25X=11Y;此时Y的取值为0≤Y<0.44;
②CaCO3+H2O+CO2═Ca(HCO3)2
100 44
Y X
=
Y=
,但是这是二氧化碳多于0.44g后消耗的碳酸钙的质量关系,所以还剩碳酸钙的质量等于生成碳酸钙最大值1减去消耗的碳酸钙的质量即:Y=1-
,即25X+11Y=22;所以此时Y取值范围:0.44≤M≤0.88
(3)生成碳酸钙最大值是1,再通入二氧化碳碳酸钙就会减少,当通到0.88g二氧化碳碳酸钙正好被消耗完.把0点、1g、0.88三个点连接起来即可.
故答案为:(1)0.74;(2)①25X=11Y;②25X+11Y=22;(3)如图;
 解:(1)设与0.44g二氧化碳反应消耗氢氧化钙的质量为z,生成沉淀质量为w则:
解:(1)设与0.44g二氧化碳反应消耗氢氧化钙的质量为z,生成沉淀质量为w则:CO2+Ca(OH)2═CaCO3↓+H2O
44 74 100
0.44g z w
| 44 |
| 0.44g |
| 74 |
| z |
| 100 |
| w |
解得z=0.74g w=1g.
(2)①CO2+Ca(OH)2═CaCO3↓+H2O
44 100
X Y
| 44 |
| X |
| 100 |
| Y |
Y=
| 100X |
| 44 |
②CaCO3+H2O+CO2═Ca(HCO3)2
100 44
Y X
| 100 |
| Y |
| 44 |
| X |
Y=
| 100X |
| 44 |
| 100(M-0.44g) |
| 44 |
(3)生成碳酸钙最大值是1,再通入二氧化碳碳酸钙就会减少,当通到0.88g二氧化碳碳酸钙正好被消耗完.把0点、1g、0.88三个点连接起来即可.
故答案为:(1)0.74;(2)①25X=11Y;②25X+11Y=22;(3)如图;
点评:解答本题容易出错的地方是碳酸钙与二氧化碳、水反应生成碳酸氢钙,使沉淀减少.

练习册系列答案
相关题目
 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.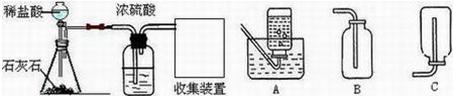
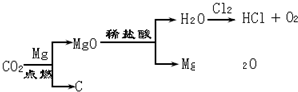
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.