题目内容
【题目】配制100g质量分数为20%的NaCl溶液。下列有关操作正确的是( )
A.取固体  B.称固体
B.称固体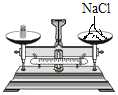 C.量取水
C.量取水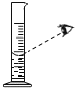 D.溶解
D.溶解 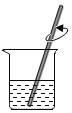
【答案】D
【解析】
配制100g质量分数为20%的NaCl溶液,其基本步骤包括:计算、称量、溶解、装瓶等,则有:
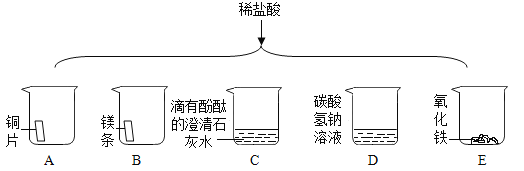
A、用药匙取用氯化钠固体,取下瓶塞倒放在桌面上,A选项操作不正确,不符合题意;
B、用托盘天平称取氯化钠,氯化钠放在左盘,砝码放在右盘,图中物品与砝码的位置放错,B选项操作不正确,不符合题意;
C、量筒量取水读数时,凹液面最低处与刻度线相切,视线与凹液面最低处相平,不能俯视读数,C选项操作不正确,不符合题意;
D、溶解在烧杯中进行,并用玻璃棒不断搅拌,加速溶解,D选项操作正确,符合题意。故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
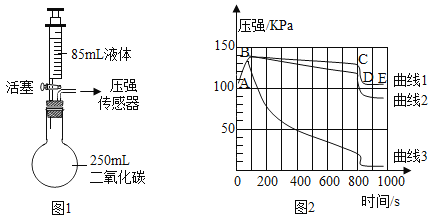
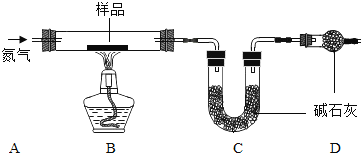
【题目】实验室制备并收集二氧化碳
(1)选用药品。按下表进行实验,取等质量的大理石加入足量酸中(杂质不与酸反应), 产生二氧化碳的体积随时间变化曲线如下图所示:

实验编号 | 药品 |
Ⅰ | 块状大理石、10%H2SO4溶液 |
Ⅱ | 块状大理石、7%HCl溶液 |
Ⅲ | 大理石粉末、7%HCl溶液 |
(1)图中丙对应实验_____(填“Ⅰ”、“Ⅱ”或“III”)。确定用乙对应的药品制备并收集二氧化碳,相应的化学方程式是_____;不用甲对应的药品,理由是:_____。
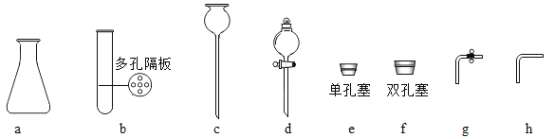
(2)搭建装置。组装可以控制反应速率的装置,应选用_____(填字母)。
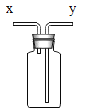
(3)收集气体。用下图装置收集时,空气从_____(填“x”或“y”)端排出。
(4)如果用(2)题搭建的装置制取氧气,发生的化学方程式是_____,其中固体物质在此反应中的作用是_____。