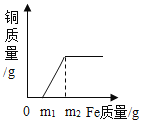
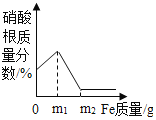
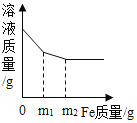
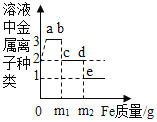
题目内容
【题目】氯碱工业生产中,以氯化钠为主要化工原料来生产烧碱。下图为某工厂的一种生产流程:
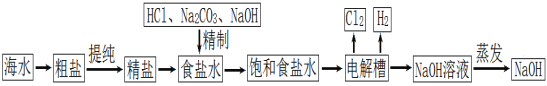
(1)从“海水→粗盐→精盐”的过程中,不涉及到的实验操作是______。
a.过滤 b.蒸发 c.洗气 d.溶解
(2)“精制”过程中加入的NaOH可除去MgCl2,写出该反应的化学方程式______。
(3)“电解槽”中,发生反应的化学方程式为______。
(4)氯碱工业的产品中常含有Na2CO3,其原因是______。
【答案】c 2NaOH+MgCl2=Mg(OH)2↓+2NaCl 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 氢氧化钠吸收空气中的二氧化碳生成碳酸钠
2NaOH+H2↑+Cl2↑ 氢氧化钠吸收空气中的二氧化碳生成碳酸钠
【解析】
海水到粗盐到精盐过程要溶解、过滤、蒸发得到精盐氯化钠,加入盐酸和碳酸钠和氢氧化钠形成饱和食盐水,在电解槽和水电解生成生成氢氧化钠、氢气和氯气,氢氧化钠溶液蒸发结晶得到氢氧化钠固体。
(1)从“海水→粗盐→精盐”的过程中,先溶解,过滤杂质,再蒸发得到粗盐,故不涉及到的实验操作是c。
(2)“精制”过程中加入的NaOH,氢氧化钠和氯化镁生成氢氧化镁白色沉淀和氯化钠,可除去MgCl2,反应的化学方程式为![]() 。
。
(3)“电解槽”中,发生反应是氯化钠和水电解生成氢氧化钠和氢气和氯气,化学方程式为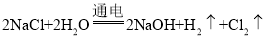 。
。
(4)氢氧化钠和二氧化碳反应生成碳酸钠和水,故氯碱工业的产品中常含有Na2CO3,其原因是氢氧化钠吸收空气中的二氧化碳生成碳酸钠。

【题目】阅读下面短文,回答相关问题。
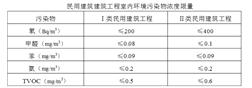
甲醛(HCHO),无色气体,有特殊的刺激气味,对人眼、鼻等有刺激作用。它是装修中不可避免的装修污染,它广泛存在于板材的粘合剂和其他的家具中,然后不断地挥发,给家居空间造成不同程度的污染。甲醛是原浆毒物,能与蛋白质中的胺基-NH2结合,使蛋白质性质发生改变,或称变性。当甲醛浓度在空气中达到0.06-0.07mg/m3时,儿童就会发生轻微气喘;达到0.1mg/ m3时,就有异味和不适感;达到0.5mg/ m3时,可刺激眼睛,引起流泪;达到0.6mg/ m3,可引起咽喉不适或疼痛。浓度更高时,可引起恶心呕吐,咳嗽胸闷,气喘甚至肺水肿;达到30mg/ m3时,会立即致人死亡,因此,我国早已制定并执行着民用建筑环境污染物限量的标准(见表1)。
为减少甲醛等有害物质的伤害,首先,要从控制污染源做起,减少接触甲醛的机会,由于甲醛释放时间非常久,最长能够达到15年,把控好建材和家具的品质至关重要。
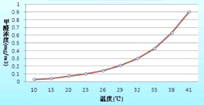
其次,释放甲醛。最有效的方法就是开窗通风,表2所示,甲醛的挥发受温度影响很大,因此,正确的做法是把门窗先关后开,关窗有利于升温,几天后再开窗会更好的让甲醛的气味消散出去。
|
|
表1 | 表2 |
第三,吸收甲醛。利用绿萝、吊兰、常春藤等植物吸收;利用活性炭其内部发达的孔隙结构能够捕捉甲醛分子,降低室内空气中的甲醛浓度;利用央视推荐的紫加黑除甲醛,其氧化分解原理对甲醛较为有效,能够把甲醛分解为二氧化碳和水。
甲醛超标对家人的危害很大,装修新房时尽量简装修降低复合板材的使用度,根据甲醛的基本性质和合理除甲醛方法治理甲醛,只有室内甲醛低于国家标准才能够入住。
(1)甲醛的相对分子质量为____。
(2)甲醛中毒的过程属于_____变化(填“物理”或“化学”)。
(3)甲醛对儿童、老人等影响最大,即使检测部门检测已达标的房间,儿童进入后也会发生轻微气喘,其原因是___。
(4)活性炭和紫加黑除甲醛的本质区别是____(从微观角度进行说明)。
(5)下列有关甲醛的说法正确的是____。
A 甲醛是无色、有特殊刺激气味的气体。
B 减少甲醛的危害,最重要的是要控制污染源,减少接触甲醛的机会。
C 每天开窗通风,并恒温在25℃,能够使甲醛很快释放完毕。
D 房间内栽培绿萝、吊兰等绿植,既美化环境,又可以吸收甲醛
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
(演示实验)将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
(学生板演)该反应的化学方程式 __________________________
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
(假设猜想)针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO和NaOH 猜想四:有______________________
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 猜想四 .
(实验探究)(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 NaOH或氢氧化钠 .
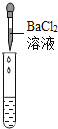
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
实验操作 |
|
|
|
实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
(得出结论)通过探究,全班同学一致确定猜想二是正确的.
(评价反思)老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出
(实验探究)(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是 ____________________
(2)实验方案中也有一个是错误的,错误的原因是____________________________