题目内容
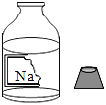
【题目】某组同学准备进行常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶溶液未盖瓶盖且标签破损(如图),决定对这瓶溶液进行实验探究:
【提出问题】这瓶是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含有钠元素的物质是氯化钠、氢氧化钠、碳酸钠
【提出猜想】猜想一:氯化钠溶液;猜想二:氢氧化钠溶液;猜想三:碳酸钠溶液.
【实验推断】
(1)小亮取样滴加无酚酞试液,溶液呈红色,得出结论:该溶液不可能是___溶液,理由是___;
(2)小辉另取样滴加稀盐酸,有_____ 产生,反应的化学方程式_____,小辉得出结论:该溶液是碳酸钠溶液.
(3)小磊认为小辉的结论不完全正确,理由是_____.小组同学讨论后一致认为还需要进行如下实验:
【继续探究】另取样加入过量的CaCl2溶液,观察到有___ 产生,设计这一步骤的目的是_____;静置后,取上层清液,滴入酚酞试液,溶液呈红色.
【实验结论】这瓶溶液是_____.
【探究启示】实验取完药品后应_____.
【答案】 氯化钠溶液 氢氧化钠和碳酸钠溶液都呈碱性能使酚酞试液变红色,氯化钠溶液呈中性 气泡 Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑ 露置于空气中的NaOH溶液与空气中的CO2反应也生成碳酸钠 白色沉淀 完全除去溶液中的碳酸钠,避免其对氢氧化钠检验造成干扰 NaOH溶液 应立即盖好瓶盖
【解析】【实验推断】
(1)酚酞遇碱性溶液变红,说明该溶液是碱性溶液,氢氧化钠和碳酸钠溶液都呈碱性,能使酚酞试液变红色,氯化钠溶液呈中性,不能使酚酞变红,故该溶液不可能是氯化钠溶液 。(2)碳酸盐与稀盐酸反应有气体生成。Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑(3)该溶液未盖瓶盖,也可能是露置于空气中的NaOH溶液与空气中的CO2反应生成了碳酸钠。【继续探究】另取样加入过量的CaCl2溶液,观察到有白色沉淀产生,设计这一步骤的目的是完全除去溶液中的碳酸钠,避免其对氢氧化钠检验造成干扰 ;静置后,取上层清液,滴入酚酞试液,溶液呈红色。【实验结论】这瓶溶液是NaOH溶液。【探究启示】实验取完药品后应立即盖好瓶盖。