题目内容
【题目】金属的回收和冶炼能有效利用金属资源
(1)某工厂欲从只含有硫酸铜的废液中回收金属铜,并得到工业原料硫酸亚铁,其工业流程如下:
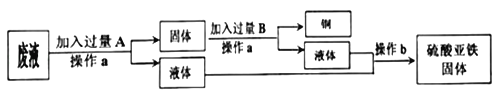
回答下列问题:
①A、B物质的名称:A为____,B为___;②A与废液主要成分反应的化学方程式为____
(2)某钢铁厂每天需消耗4900t含氧化铁76%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量__。
【答案】 铁 稀硫酸 Fe+CuSO4═FeSO4+Cu 2660t
【解析】(1)①欲从只含有硫酸铜的废液中回收金属铜,并得到硫酸亚铁,故A是铁,Fe+CuSO4═FeSO4+Cu。因为要得到硫酸亚铁,故B是稀硫酸,Fe+ H2SO4 == FeSO4 + H2↑。②废液的主要成分是硫酸铜,铁与硫酸铜反应的化学方程式为:Fe+CuSO4═FeSO4+Cu。
(2)4900t赤铁矿石中氧化铁的质量为:4900t×76%=3724t,设理论上可日产含铁98%的生铁的质量是x,则生铁中铁的质量为x×98%。
Fe2O3+3CO 高温2Fe+3CO2
160 112
3724t x×98%
![]() =
=![]() ,解得x=2660t
,解得x=2660t

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目