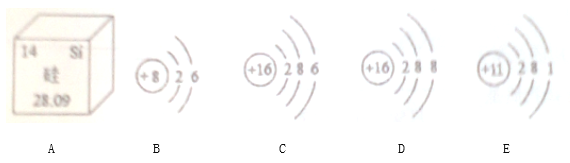
题目内容
【题目】在一定条件下,一个密闭容器内发生某反应,测得反应过程中各物质的质量部分数据如下表所示.下列未知数据计算正确的是( )
物 质 | a | b | c | d |
反应前的质量/g | 20 | 20 | 0 | 0 |
反应一段时间后的质量/g | 12 | 4 | 6 | ① |
反应后的质量/g | ② | 0 | ③ | ④ |
A. ①为22g B. ②为8g C. ③为12g D. ④为22.5g
【答案】D
【解析】a反应前20g,反应一段时间变为12g,说明属于反应物,且参加反应的质量为:20g-12g=8g;b反应前20g,反应一段时间变为4g,说明属于反应物,且参加反应的质量为:20g-4g=16g;c反应前是0,反应一段时间后变为6g,说明是生成物,且生成了:6g-0=6g;根据质量守恒定律可知d必须是生成物,且生成的质量为:8g+16g-6g=18g,所以生成18gd,所以①是18g;根据上边的a与b参加反应的质量比为:8g:16g=1:2;因为b由4g变为0说明消耗了4g,所以a消耗的质量为2g,原来是12g,消耗了2g,还剩10g,所以②为10g;根据参加反应的物质的质量总和等于反应后生成的各物质的质量总和,所以生成c和d的质量总和与参加反应的a与b的质量总和相等,a与b的质量总和:4g+2g=6g所以c和d的质量总和也是6g,又因为生成的c和d的质量比为6g︰18g=1︰3,所以c占![]() 所以c的质量为6g×
所以c的质量为6g×![]() =1.5g;d占
=1.5g;d占![]() ,所以d的质量为6g×
,所以d的质量为6g×![]() =4.5g;所以③为6g+1.5g=7.5g;④为:18g+4.5g=22.5g,故D正确;故选D。
=4.5g;所以③为6g+1.5g=7.5g;④为:18g+4.5g=22.5g,故D正确;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】同学们尝试获取含有色素的“紫甘蓝提取液”,并探究该提取液能否作为酸碱指示剂。
将撕碎的紫甘蓝叶片用纯净水浸泡,过滤后即可得到蓝色的提取液。
实验1-探究紫甘蓝提取液颜色随溶液pH的变化。
用盐酸、NaOH、水配制一定pH的溶液,分别向其中加入10滴紫甘蓝提取液,溶液的颜色如下。
溶液pH | 2 | 4 | 7 | 10 | 12 |
溶液颜色 | 红 | 红 | 蓝 | 绿 | 绿 |
实验2-用紫甘蓝提取液检测常见溶液的酸碱性。
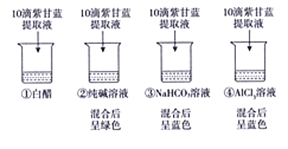
【解释与结论】
(1)紫甘蓝中的色素____(填“能”或“不能”)溶于水。
(2)依据实验现象判断,Na2C03溶液呈____(填“酸性”“中性”或“碱性”)。
(3)若白醋的pH为3,则白醋中滴加紫甘蓝提取液后,混合溶液的颜色为 ___。
(4)根据目前的实验现象,不能断定NaHC03溶液呈中性,理由是____________。
【反思与评价】
(5)同学们查阅资料知AlCl3溶液的pH通常在3—4之间,由此判断实验2中,溶液④呈蓝色不是溶液酸碱性导致的,理由是____________________。
(6)同学们认为紫甘蓝提取液不是良好的酸碱指示剂,原因是____。
【题目】下列各组表述全部正确的是
A.人体健康 | B.解释说明 |
①缺铁易使幼儿患侏儒症 ②人体所需维生素量不多,但不能缺少 | ①油锅着火,用锅盖盖灭,因为隔绝氧气 ②O2、CO2化学性质不同,因为分子结构不同 |
C.中和反应 | D.化学原理 |
①在酸碱中和后的溶液中滴加酚酞试液, 无法判断是否恰好反应 ②在NaOH固体中滴加稀盐酸,温度升高,可检验中和反应是否放热 | ①正常雨水弱酸性CO2+H2O ②治疗胃酸过多 2Al(OH)3+3H2SO4 |
A. A B. B C. C D. D