题目内容
【题目】央视频道《是真的吗?》栏目中有一段视频:将“锡纸”剪成一段两头宽中间窄的纸条,然后两头分别连接电池的正负极,观察到“锡纸”立即燃烧。据此,某同学取“锡纸”进行了以下探究:

探究一:“锡纸”燃烧的原因
“锡纸”两端接入电池两极后造成短路致使“锡纸”燃烧,从燃烧的条件开始“锡纸”不燃烧但短路后却能燃烧的原因是_______(填“与氧气接触”或“温度达到着火点”)。
探究二:“锡纸”中金属的成分
(提出问题)“锡纸”中的金属是锡吗?
(查阅资料)①“锡纸”是锡箔或铝箔
②锌粉是一种深灰色固体
③锡(Sn)与酸或金属化合物溶液反应生成+2价锡的化合物
(提出猜想)猜想Ⅰ:“锡纸”中的金属是锡 猜想Ⅱ:“锡纸”中的金属是铝
(进行实验)设计方案并进行实验
实验操作 | 实验现象 | 实验分析与结论 |
取打磨后的“锡纸”片放入试管中,滴加氯化锌溶液 | “锡纸”表面有深灰色固体析出 | 根据实验现象,结合金属活动性顺序 可知猜想_____(填“Ⅰ”或“Ⅱ”)成立; |
(交流讨论)(1)实验中打磨“锡纸”的目的是_________。
(2)下列物质的溶液可以替代氯化锌溶液完成上述实验的是_______(填字母序号)。
A.氯化铜 B.硝酸银 C.硫酸钠 D.硫酸亚铁
(拓展应用)证明铁、铜、银三种金属活动性顺序的实验方案如下,请将内容补充完整。
实验操作 | 实验现象 | 实验结论 |
| ______ | 写出有关反应的化学方程式 __________ 铁、铜、银三种金属的活动性顺序是:Fe>Cu>Ag |
【答案】温度达到着火点 Ⅱ 除去表面的氧化物 D 试管①:铁表面生成红色固体,溶液由蓝色变成浅绿色;试管②:无现象 Fe+CuSO4=FeSO4+Cu
【解析】
(1)根据燃烧的条件来分析;
(2)[进行实验]根据金属的活动性来分析;
[交流讨论]①“锡纸”的表面有氧化物;
②根据金属的活动性来分析;
[拓展应用]在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来。设计实验证明金属的活动性顺序,可以使用活动性居中的金属为单质、强和弱的金属为盐溶液的方法,或是活动性居中的金属为盐溶液,强和弱的金属为单质的方法,也可以使用加酸观察是否产生气体的方法。
(1)“锡纸”与氧气接触,但是开始“锡纸”不燃烧而短路后却能燃烧的原因是短路时,温度升高,温度达到了“锡纸”的着火点;
[进行实验]铝比锌活泼,而锡不如锌活泼,所以打磨后的“锡纸”片放入试管中,滴加氯化锌溶液;若有深灰色固体析出则为铝,若没有深灰色固体析出则为锡;铝与氯化锌反应生成锌和氯化铝;
[交流讨论]①实验中打磨“锡纸”的目的是除去表面的氧化物;
②选择的盐溶液中的金属元素应介于铝和锡之间,铜和银均排在锡的后面,钠排在铝的前面,而铁介于二者之间;
[拓展应用]在金属活动性顺序中,Fe>Cu>Ag,使用活动性强的金属铁和活动性弱的金属银,则可以用铜的盐溶液;所以,实验方案是:把铁和银放入硫酸铜溶液中,铁表面有红色物质析出,溶液由蓝色变成浅绿色;银与硫酸铜不反应,证明锌铁的活动性比铜强,铜的活动性比银强;反应的化学方程式:Fe+CuSO4=FeSO4+Cu。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】某化学兴趣小组的同学们对木炭和氧化铜在高温条件下反应实验进行了探究。
[提出问题]生成的气体产物的成分是什么呢?
[作出猜想]猜想1.二氧化碳;猜想2.一氧化碳;猜想3.________________。
[设计实验]
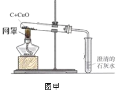
实验一.同学们设计如图甲所示装置进行实验,甲、乙同学根据实验现象得出结论如下:
实验现象 | 实验结论 | |
甲 | 澄清的石灰水变浑浊 | 猜想1正确 |
乙 | 澄清的石灰水不变浑浊 | 猜想2正确 |
(1)同学们对甲、乙同学由现象得出的结论进行了分析和评价,其中由现象得出的结论不科学的是________(填“甲”或“乙”)。
实验二.同学们讨论后,又设计了如图乙所示的装置进行实验。
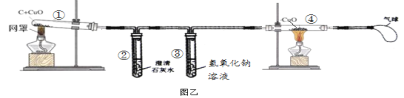
(2)能证明猜想3正确的的现象是_________________和____________________。
(3)实验后发现试管②内壁上附着不易用试管刷洗净的固体生成物,清洗试管②的
方法是_______________________。
【题目】请从A或B两组趣味实验中任选1个作答,若两题均作答,按A计分。
A | B |
(1)向一盛有少量干冰的玻璃容器中加入适量热水,立即产生浓厚的白雾,产生此现象的原因是。____ (2)另取一盛有适量澄清石灰水的玻璃容器,向其中加入少量干冰,观察到澄清石灰水变浑浊,发生反应的化学方程式为______。 |
(1)点燃蜡烛后,电子秤示数逐渐减小。蜡烛减小的质量____(填“大于”“等于”或“小于”)燃烧后生成物的总质量。
(2)用玻璃杯迅速扣住燃烧的蜡烛,并使杯口始终浸没在水中最终杯中液面____(填“高于”“等于”或“低于”)碗中液面。 |
【题目】某化学兴趣小组根据下列转化关系在实验室中模拟炼铁,并对产物成分进行探究。
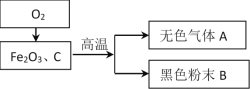
(1)炼铁的原理是______________________________(用化学方程式表示)。
(2)甲、乙两个兴趣小组分别对无色气体A和黑色粉末 B的成分进行探究。
(猜想与假设)
甲组在分析了炼铁的原理后,认为无色气体A中可能有CO2,也可能有未反应的_____。
乙组认为黑色粉末的成分中存在以下两种情况:
假设一:只含有铁。假设二:含有______________________________。
(实验探究)
①为验证甲组的猜想,同学们按下图所示装置进行实验(箭头表示气体流向)。
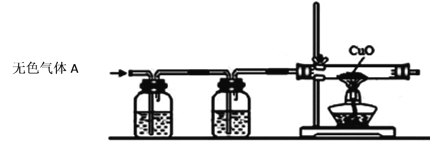
Ⅰ澄清石灰水Ⅱ浓硫酸Ⅲ氧化铜粉末
上述实验装置Ⅱ中浓硫酸的作用是吸收水蒸气,装置Ⅰ的作用是_______________,装置Ⅲ的作用是_________________。当看到Ⅰ中澄清石灰水变浑浊,Ⅲ中黑色固体变成红色后,可以确定无色气体A的成分是__________。
②为验证乙组中假设二是否成立,请你设计实验用化学方法完成以下探究。
实验方法 | 实验操作 | 实验现象 | 实验结论 |
化学方法 | _____ | _____ | 假设二成立 |
(交流反思)针对甲组实验存在的缺陷,同学们一起进行了改进,解决了污染环境问题。