题目内容
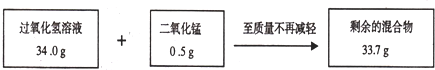
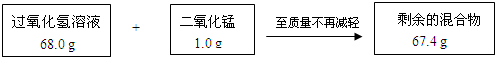
某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,实验测得相关数据如图所示:

(1)剩余的混合物中二氧化锰的质量为________g,反应生成氧气的质量为________g.
(2)该过氧化氢溶液中溶质质量分数为多少?
解:(1)由于二氧化锰是反应的催化剂,质量不变,所以,剩余的混合物中二氧化锰的质量为2.0g,根据质量守恒定律,减少的质量就是生成的氧气的质量即:68.0g+2.0g-68.4g=1.6g
(2)设68.0 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2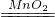 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
 解得:x=3.4g
解得:x=3.4g
过氧化氢溶液的溶质的质量分数= ×100%═5%.
×100%═5%.
故答为:(1)2.0g,1.6g;(2)该过氧化氢溶液中溶质的质量分数为5%.
分析:根据图示测得的相关数据及相关的过氧化氢分解的化学方程式,依据质量守恒定律计算生成氧气的质量,再根据已知的氧气质量代入化学方程式求得参加反应的过氧化氢的质量,最后可求得过氧化氢溶液中溶质的质量分数.
点评:解此题的关键是根据图示测得的相关数据及质量守恒定律计算出隐藏的已知量---生成的氧气质量;进而按化学方程式的解题格式解答即可.
(2)设68.0 g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2
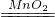 2H2O+O2↑
2H2O+O2↑68 32
x 1.6g
 解得:x=3.4g
解得:x=3.4g 过氧化氢溶液的溶质的质量分数=
 ×100%═5%.
×100%═5%.故答为:(1)2.0g,1.6g;(2)该过氧化氢溶液中溶质的质量分数为5%.
分析:根据图示测得的相关数据及相关的过氧化氢分解的化学方程式,依据质量守恒定律计算生成氧气的质量,再根据已知的氧气质量代入化学方程式求得参加反应的过氧化氢的质量,最后可求得过氧化氢溶液中溶质的质量分数.
点评:解此题的关键是根据图示测得的相关数据及质量守恒定律计算出隐藏的已知量---生成的氧气质量;进而按化学方程式的解题格式解答即可.

练习册系列答案
相关题目